题目内容
石墨烯是由碳原子构成具有片状结构的新型纳米材料(结构示意图如下),可通过剥离石墨而成,具有极好的应用前景。下列说法正确的是
| A.石墨烯是一种有机化合物 |
| B.0.0012kg石墨烯中含有0.6mol质子 |
| C.不用其它试剂,利用丁达尔现象即可区分石墨和石墨烯 |
| D.剥离石墨属于物理变化过程 |
B
解析试题分析:有机物即有机化合物。含碳化合物(一氧化碳、二氧化碳、碳酸、碳酸盐、金属碳化物、氰化物除外)或碳氢化合物及其衍生物的总称。而石墨烯只含有碳元素属于应属于单质,A错。1.2g石墨烯是0.1mol,所以质子的物质的量是0.6mol,所以B正确。石墨烯虽然是纳米材料但是表面必须吸附带电的离子分散到分散剂才能形成胶体,所以直接用丁达尔现象不能区分C错。由石墨到石墨烯生成了新的物质属于化学反应D错。
考点:考查物质的分类和概念,原型是根据2009年安徽高考题改编的。

金属的下列性质中与金属晶体结构无关的是( )
| A.导电性 | B.化学反应中易失去电子 |
| C.延展性 | D.硬度 |
“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。A165Cu23Fel2是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是:
| A.A165Cu23Fel2的硬度比金属A1、Cu、Fe都大 |
| B.A165Cu23Fel2中三种金属的化合价均可视作零 |
| C.A165Cu23Fel2不可用作长期浸泡在海水中的材料 |
| D.1mol A165Cu23Fel2溶于过量的硝酸时共失去265 mol电子 |
关于晶体的下列说法正确的是
| A.晶体中只要有阴离子就一定有阳离子 |
| B.晶体中只要有阳离子就一定有阴离子 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.分子晶体的熔点一定比金属晶体的低 |
根据下列性质判断,属于原子晶体的物质是
| A.熔点2 700 ℃,导电性好,延展性强 |
| B.无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂 |
| C.无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电 |
| D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电 |
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )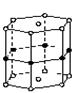
| A.MgB | B.Mg3B2 |
| C.MgB2 | D.Mg2B3 |
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+O2(g)=2H2O(g) △H2
C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是 ( )
| A.该晶体属于原子晶体,其化学键比金刚石中的化学键更牢固 |
| B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 |
下列物质的熔、沸点高低顺序中排列正确的是 ( )
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CH4 |
| C.MgO>O2>N2>H2O | D.金刚石>生铁>纯铁>钠 |