题目内容
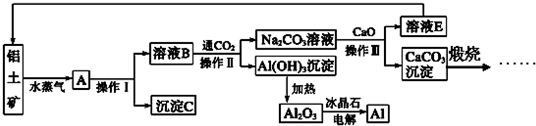
CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:

回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+![]() Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。
Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。
。
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
(1)CuO+2H+→Cu2++H2O(2)烧杯、量筒(3)SO2(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有(5)铜粉的质量 最终所得CuO的质量。
解析:
本题考查工业流程题。(1)氧化铜与硫酸反应的离子方程式;(2)配制硫酸溶液需要的玻璃仪器有烧杯、量筒和玻璃棒;(3)因为是1:1的硫酸,浓度较大,铜没有氧化完全,可能含有部分的Cu2O,与硫酸反应氧化还原反应,生成二氧化硫气体;(4)取少许样品,加入稀H2SO4,若溶液中出现红色沉淀,说明样品中中含有Cu2O,反之则没有;(5)如果铜没有损耗,则根据铜元素的守恒,测得最终所得CuO的质量即可求出样品铜的质量,再测得原铜粉的质量,就可以求出铜粉中Cu的含量。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
| |||||||||||||||||||||||
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.