题目内容
在相同条件下(500K),相同体积的甲、乙两密闭容器,甲容器充入1g SO2(g)和1g O2(g),乙容器充入2gSO2(g)和2g O2(g),发生下列反应:2SO2(g)+O2(g) 2SO3(g),下列叙述错误的是
2SO3(g),下列叙述错误的是
[ ]
A.起始时的化学反应速率:乙>甲
B.平衡后SO3的浓度:乙>甲
C.SO2的转化率:乙>甲
D.平衡后SO2的体积分数:乙>甲
答案:D
解析:
解析:
|
【解析】此题考查的是同一反应在不同的条件下进行的不同情况.甲、乙两密闭容器体积相同,乙容器中SO2和O2是甲容器的二倍,乙容器中反应物的浓度及气体的压强都比甲容器大.所以化学反应速率乙>甲,A对;此反应是一个反应前后气体体积减小的反应,压强越大越有利于反应向正反应方向移动,所以乙容器中的反应正向进行的程度要比甲容器大,平衡后SO3的浓度乙>甲,B对;SO2的转化率乙>甲,C对;而平衡后SO2的体积分数乙<甲,D错. |

练习册系列答案
相关题目

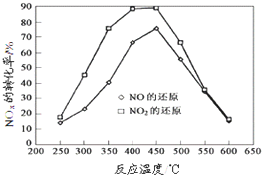 在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,