题目内容
9.硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:
反应釜中发生反应:4NH4 Cl+Mg2 Si$\stackrel{常温}{?}$ 4NH3↑+SiH4↑+2MgCl2△H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3N4应属于原子晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是Si3N4>NH3>SiH4.
(2)上述生产硅烷的过程中反应釜抽真空的原因是使4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2平衡正移,有利于生产硅烷.
(3)液氨参与循环的作用是吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可).
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol.
(5)三硅酸镁( Mg2Si3O8•nH2O)难溶于水,在医药上可做抗酸剂.它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与胃酸反应的化学方程式是MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O.若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8•nH2O中n的值是6.
分析 (1)相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,其构成微粒是原子;不同类型晶体熔沸点高低的比较:一般来说,原子晶体>离子晶体>分子晶体;分子晶体中含有氢键的熔沸点较高;同种类型的分子晶体相对分子质量越大,熔沸点越高;
(2)生产硅烷的反应为可逆反应,抽成真空,能使反应平衡正移,有利于生产硅烷;
(3)根据氨的性质分析:氨气易液化,液氨气化时能从周围环境吸热降温;
(4)依据热化学方程式的书写方法分析书写,反应热与化学计量数成正比;
(5)根据书写化学方程式的步骤:写配注等,正确书写方程式即可,三硅酸镁和盐酸反应生成氯化镁、二氧化硅和水,根据化学方程式进行计算Mg2Si3O8•nH2O中n的值.
解答 解:(1)相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,其构成微粒是原子;原子晶体具有熔点高和硬度大的特点,氮化硅(Si3N4)是一种耐高温材料,说明氮化硅属于原子晶体,NH3、Si3N4和SiH4三种物质,Si3N4为原子晶体,NH3、SiH4是分子晶体,则熔沸点顺序为:Si3N4>NH3、SiH4,NH3中含有氢键、SiH4中不含氢键,所以NH3的熔沸点较高,即Si3N4>NH3>SiH4,
故答案为:原子;Si3N4>NH3>SiH4;
(2)生产硅烷的反应为4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2,该反应为可逆反应,正反应为气体体积增大的反应,抽成真空,有利于反应平衡正向移动,有利于生产硅烷,
故答案为:使4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2平衡正移,有利于生产硅烷;
(3)氨气易液化,液氨气化时能从周围环境吸热降温,上述生产硅烷的过程中液氨的作用是:吸收热量,保证反应在常温下进行,
故答案为:吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可);
(4)氨气催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,则4mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ×4=906KJ的热量,所以该反应的热化学方程式是:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol;
(5)三硅酸镁中和胃酸(HCl)的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×1mol/L-0.030L×1mol/L
$\frac{1}{x}$=$\frac{4}{0.050L×1mol/L-0.030L×1mol/L}$,
解得x=0.005mol,所以MgSi3O8•nH2O的摩尔质量是M=$\frac{m}{n}$=$\frac{1.84}{0.005}$=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6.
故答案为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O;6.
点评 本题考查较为综合,涉及硅、氮及其化合物的性质以及工业流程的理解、复杂化学式的确立等知识,要求学生具有较强的分析和解决问题的能力,明确反应原理是解答本题的关键,题目难度中等.

| A. | 维勒用无机物合成了尿素,突破了无机物和有机物的界限 | |
| B. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| C. | 羟基不带电,氢氧根带一个单位负电荷,氢氧根比羟基稳定 | |
| D. | 苯分子中不存在单双键交替的事实是苯的邻二取代物没有同分异构体 |
 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+;
(3)资料显示:SCN -的电子式为
 .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明
SCN-中被氧化的元素是硫元素;
②甲同学通过实验证明了SCN-中氮元素转化为NO3-,已知SCN-中碳元素没有被氧化,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒.有少量因爆炸冲击发生泄漏.这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染.
(1)写出NaCN的电子式Na+
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 乙醇的结构式为: | |
| C. | 用电子式表示Na2S的形成过程可表示为: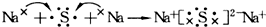 | |
| D. | 丙烷的比例模型为: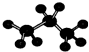 |
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
(2)在298K时,取1mol N2和3mol H2放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为93kJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2的大小关系是Q1>Q2,理由该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.


