题目内容
14.为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
(1)仪器a的名称为:分液漏斗;在组装好上述实验装置后,在装入药品之前必需的实验操作是检查装置的气密性.
(2)写出A中发生反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)装置B的作用是除去混合气体中二氧化硫
(4)已知SO2也可以使澄清的石灰水变浑浊,则能说明产物中一定存在CO2气体的实验现象为C中品红不褪色,D中溶液出现白色沉淀.
分析 碳和浓硫酸在加热条件下反应生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,品红溶液用于检验SO2是否除干净.
(1)由图可知仪器a的名称,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性;
(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,以此写出化学方程式;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液吸收SO2;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体.
解答 解:碳和浓硫酸在加热条件下反应生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,品红用于检验SO2是否除干净.
(1)由图可知仪器a为分液漏斗,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性,
故答案为:分液漏斗;检查装置的气密性;
(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液除掉SO2;
故答案为:除去混合气体中二氧化硫;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体,
故答案为:C中品红不褪色,D中溶液出现白色沉淀.
点评 本题考查了浓硫酸的强氧化性,侧重于SO2和CO2性质的比较,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,为高频考点,有利于培养学生的良好的科学素养,提高学生学习实验的积极性,难度不大.

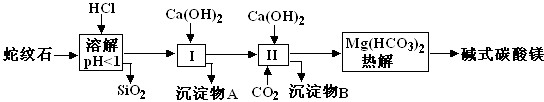
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+(填离子符号).
(2)进行Ⅰ操作时,控制溶液的pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3(填化学式,下同)溶解、,Mg(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2.
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
Ⅰ.①称量样品,②高温分解,③用浓硫酸吸收水蒸气,④称量碱石灰吸收CO2前后的质量,⑤称出MgO.
Ⅱ.18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:a=3,b=1,c=3.
 H是为了使Al3+转化为Al(OH)3,进入固体2
H是为了使Al3+转化为Al(OH)3,进入固体2 H2O
H2O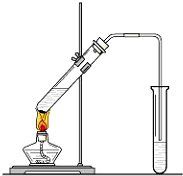 在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题: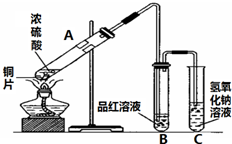 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.
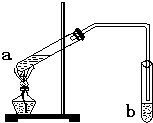 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题: