题目内容
下列叙述中正确的是( )
| A、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| B、碳酸钠溶液呈碱性,医疗上常用碳酸钠治疗胃酸过多 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
考点:氯、溴、碘及其化合物的综合应用,水的电离,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,化学应用
分析:A、二氧化氯具有氧化性,能杀菌消毒;
B、碳酸钠和盐酸反应剧烈生成大量的二氧化碳;
C、水的离子积大小和温度有关,酸碱会抑制水的电离;
D、沉淀可以向着更难溶的方向进行,碳酸钙是能溶于盐酸的.
B、碳酸钠和盐酸反应剧烈生成大量的二氧化碳;
C、水的离子积大小和温度有关,酸碱会抑制水的电离;
D、沉淀可以向着更难溶的方向进行,碳酸钙是能溶于盐酸的.
解答:
解:A、二氧化氯具有氧化性,可用于自来水的杀菌消毒,故A错误;
B、碳酸钠和盐酸反应剧烈生成大量的二氧化碳,不能用于治疗胃酸过多,会导致胃穿孔,故B错误;
C、向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温都能使水的离子积减小,故C错误;
D、锅炉中沉积的CaSO4用Na2CO3溶液浸泡后,会生成碳酸钙和硫酸钠,碳酸钙可以用稀盐酸溶解去除,故D正确.
故选D.
B、碳酸钠和盐酸反应剧烈生成大量的二氧化碳,不能用于治疗胃酸过多,会导致胃穿孔,故B错误;
C、向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温都能使水的离子积减小,故C错误;
D、锅炉中沉积的CaSO4用Na2CO3溶液浸泡后,会生成碳酸钙和硫酸钠,碳酸钙可以用稀盐酸溶解去除,故D正确.
故选D.
点评:本题考查学生二氧化氯、碳酸钠的性质、水的电离、水的离子积以及沉淀转化等知识,属于综合知识的考查题,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
将右图所示实验装置,下列判断正确的是( )


| A、电子沿Zn→a→b→Cu路径流动 |
| B、铜电极上发生氧化反应 |
| C、盐桥中的K+向甲烧杯移动 |
| D、片刻后可观察到滤纸a点变红色 |
下列反应属于非氧化还原反应的是( )
A、Fe2O3+3CO
| ||||
B、NH4NO3
| ||||
C、CaCO3
| ||||
D、4CuO
|
无色透明溶液中,可以大量共存的是( )
| A、Ca2+、Na+、NO3-、SO42- |
| B、HCO3-、Na+、Cl-、H+ |
| C、Mg2+、Cl-、Cu2+、SO42- |
| D、K+、Ba2+、Cl-、NO3- |
密闭容器中进行如下反应:X2(g)+3Y2(g)?2Z (g),X2、Y2、Z的起始的物质的量分别为0.2mol、0.6mol、0.4mol,当达到平衡时,下列数据肯定不正确的是( )
| A、X2为0.4mol,Y2为1.2mol |
| B、Y2为1.0mol |
| C、X2为0.3mol,Z为0.2mol |
| D、Z为0.6mol |
下列叙述正确的是( )
| A、Li在氧气中燃烧主要生成Li2O2 | ||||
| B、实验室制备Cl2可用排饱和食盐水集气法收集 | ||||
C、
| ||||
| D、碱金属和卤素的单质的熔沸点随原子序数递增均依次升高 |
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A、MnO4-、K+、Na+、SO42- |
| B、Na+、K+、HCO3-、Cl- |
| C、Mg2+、NH4+、Cl-、NO3- |
| D、Ba2+、K+、S2-、SO42- |
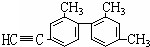 已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )| A、分子中处于同一直线上的碳原子最多有7个 |
| B、分子中至少有12个碳原子处于同一平面上 |
| C、该烃苯环上的一氯代物共有3种 |
| D、该烃苯环上一氯代物共有5种 |