题目内容
19.在一定条件下,可逆反应:mA+nB?C达到平衡状态.(1)若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n<p.
(2)若A、C是气体,增加B的量,平衡不移动,则B的状态为固态或纯液态.
(3)若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则说明m<p,即平衡移动的方向是逆反应方向
(4)若加热后,可使C的质量增加,则正反应是吸热反应.
分析 根据外界条件(浓度、温度、压强)对化学平衡的影响,一定条件下的可能反应,改变其中一个条件,平衡向减弱这种改变的方向移动.
解答 解:(1)因减小压强,平衡向气体体积增大的方向移动,所以m+n<p,故答案为:<;
(2)增加B的量,平衡不移动,说明B的浓度不变,可以是液体也可以是固体,故答案为:固态或纯液态;
(3)因增大压强,平衡向气体体积减小的方向移动,A、C是气体,而且m+n=p,所以B不是气体,则m<p,即平衡移动的方向是逆反应方向,故答案为:m<p,即平衡移动的方向是逆反应方向;
(4)因温度升高,平衡向吸热的方向移动,C的质量增加,说明正反应是吸热反应,故答案为:吸热.
点评 本题考查了化学平衡影响因素分析,解答本题的关键是外界条件(浓度、温度、压强)对化学平衡的影响,然后对问题做出正确的判断,题目较简单.

练习册系列答案
相关题目
18.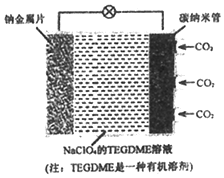 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )| A. | 放电时,钠金属片作负极,碳纳米管作正极 | |
| B. | 充电时,阳极反应为:2Na2CO3+C-4e-═3CO2↑+4Na+ | |
| C. | 放电时,Na+从负极区向正极区移动 | |
| D. | 该电池的电解质溶液也可使用NaClO4的水溶液 |
19.已知 A、B、C、D是短周期中原子序数依次增大的四种主族元素,A单质在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显酸性 |
7.下列实验操作或结论正确的是( )
| A. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| B. | 金属钠着火时,立即用泡沫灭火器进行灭火 | |
| C. | 浓硫酸溅到皮肤上时立即用大量水冲洗,再涂上NaHCO3溶液 | |
| D. | 向未知液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定存在SO42-或SO32- |
14.以下物质可以通过化合反应及氧化还原反应制得的是( )
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
| A. | 全部 | B. | ①②③ | C. | ①②③④ | D. | ①②④⑥ |
4.化学是一门以实验为基础的科学,化学实验是化学学习的重要内容.下列说法不正确的是( )
| A. | 从试剂瓶中取出的液体药品若有剩余,则不能再放回原试剂瓶 | |
| B. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| C. | 蒸馏时蒸馏烧瓶中的液体不能超过蒸馏烧瓶的$\frac{2}{3}$ | |
| D. | 在天平的两托盘上各放一张质量相同的滤纸,将NaOH固体放在左盘滤纸上称量 |
11.下列条件下,两瓶气体所含的原子数一定相等的是( )
①同质量不同密度的CO和N2②同温同体积的H2和Cl2
③同温同压同体积的N2和O2④同压同体积的N2O和CO2.
①同质量不同密度的CO和N2②同温同体积的H2和Cl2
③同温同压同体积的N2和O2④同压同体积的N2O和CO2.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
8.维生素C的结构简式为  ,有关它的叙述错误的是( )
,有关它的叙述错误的是( )
 ,有关它的叙述错误的是( )
,有关它的叙述错误的是( )| A. | 强还原性 | |
| B. | 易起氧化及加成反应 | |
| C. | 易溶于水 | |
| D. | 加热难分解,在碱性溶液中能稳定地存在 |
9.下列物质属于共价化合物的是( )
| A. | CO2 | B. | NaCl | C. | N2 | D. | NH4Cl |