题目内容
19. (1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积
(1)某工厂用NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥.若反应所消耗的NH3和空气的体积比为4:5(空气中O2的体积分数以$\frac{1}{5}$计),则处理废气时发生反应的总化学方程式为12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3.若该工厂用此方法处理废气,一天中消耗了空气336m3(假定反应中O2无损失),则生成化肥的总质量为0.848
(2)该工厂废气中含有大量温室气体-CO2.为减少碳排放,该工厂尝试用以下反应制备甲醇:
CO2+3H2?CH3OH+H2O.一定温度下,在恒容的密闭容器中充入1mol CO2和3mol H2.实验测得CO2和CH3 OH (g)的浓度随时间变化如图所示.0-10分钟内,CH3OH的生成速率为0.075mol/(L•min),达平衡时,CO2转化率为75%,若第10min时,向容器中再通人3mol H2,再次达平衡时,CO2的转化率会增大(填“增大”、“减小”或“不变”).
分析 (1)NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥,可知氨气、氧气、二氧化硫和二氧化氮发生氧化还原反应,生成硫酸铵和硝酸铵,反应方程式为:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3;根据关系式3O2~4(NH4)2SO4+4NH4NO3来分析来解;
(2)根据v=$\frac{△c}{△t}$;达平衡时,CO2转化率为$\frac{变化量}{起始量}×100%$,容器中再通入3molH2,CO2的转化率会增大.
解答 解:(1)NH3和空气来联合处理工厂尾气中的等体积SO2和NO2,不仅除去了有害气体,还得到副产品-含两种按盐的化肥,可知氨气、氧气、二氧化硫和二氧化氮发生氧化还原反应,生成硫酸铵和硝酸铵,反应方程式为:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3;生成化肥的总质量为 m,则
3O2 ~4(NH4)2SO4 +4NH4NO3
3×22.4L 4×132+4×80
336×$\frac{1}{5}$×103L m
$\frac{3×22.4L}{336×\frac{1}{5}×1{0}^{3}}=\frac{4×132+4×80}{m}$
解得m=0.848t,故答案为:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3;0.848;
(2)v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),CO2转化率=$\frac{(1-0.25)mol/L×1L}{2mol}×100%$=75%,容器中再通入3molH2,CO2的转化率会增大,故答案为:0.075mol/(L•min);75%;增大.
点评 本题主要考查了氧化还原反应和化学反应速率的计算、转化率的计算、影响平衡移动的因素,中等难度,解题时注意基础知识的灵活运用.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| 物质 | a | b | c | d |
| 反应前的质量(g) | 6.4 | 3.2 | 4.0 | 2.8 |
| 反应后的质量(g) | 5.2 | X | 7.2 | 2.8 |
| A. | a和c是反应物 | B. | d一定是催化剂 | ||
| C. | X=2.0g | D. | 该反应是化合反应 |
| A. | 0.1molNa与足量O2反应,转移0.2nA个电子 | |
| B. | 1L0.1mol•L-1Na2S溶液中含有0.1nA个S2- | |
| C. | 常温下,44gCO2含有nA个C原子 | |
| D. | 标准状况下,22.4L的CCl4含有4nA个Cl原子 |
| A. | 加热氧化铝 | B. | 电解熔融氯化镁 | C. | 加热碳酸钠 | D. | 电解饱和食盐水 |
| A. | 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO-3═Fe3++NO↑+2H2O | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- |
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 实验室以H2O2和MnO2为原料制取O2,每生成1mol O2转移2NA个电子 |
| A. | 约3.3 | B. | 8 | C. | 6 | D. | 4 |

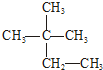 ③C60 ④氯气 ⑤
③C60 ④氯气 ⑤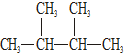 ⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.
⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.