题目内容
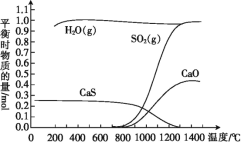
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
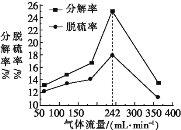
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。
(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
【答案】Ⅱ 4ΔH1-ΔH2 > 正向 BC 生成的SO2在过量H2的作用下又重新生成CaS或CaSO4 262
【解析】
(1)由图可知,100 ℃~700 ℃反应达到平衡时,水蒸气和硫化钙的物质的量比为1.0mol:0.25mol=4:1;
(2)由盖斯定律可知,Ⅰ×4—Ⅱ=Ⅲ,则ΔH3=4ΔH1-ΔH2;由图可知,升高温度,生成物二氧化硫和氧化钙的物质的量增大,说明平衡向正反应方向移动;
(3)由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,平衡向逆反应方向移动,重新平衡时,容器内二氧化硫的浓度和物质的量不变,CaSO4(s)的质量增大,CaS(s)的质量减小;
(4)在氢气流量高于242 mL·min-1时,导致氢气过量,反应生成的二氧化硫在过量氢气的作用下重新生成硫化钙和硫酸钙;
(5)反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=
CaSO4(s)的K'p=![]() 。
。
(1)由图可知,100 ℃~700 ℃反应达到平衡时,水蒸气和硫化钙的物质的量比为1.0mol:0.25mol=4:1,由题给化学方程式的化学计量数可知,主要发生反应Ⅱ,故答案为:Ⅱ;
(2)由盖斯定律可知,Ⅰ×4—Ⅱ=Ⅲ,则ΔH3=4ΔH1-ΔH2;由图可知,升高温度,生成物二氧化硫和氧化钙的物质的量增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:4ΔH1-ΔH2;>;正向;
(3)A.由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,重新平衡时,容器内二氧化硫的浓度和物质的量不变,气体总压强不变,故错误;
B. 达到平衡时向容器中再充入少量SO2,生成物浓度增大,平衡向逆反应方向移动,重新平衡时,CaO的量减少,故正确;
C. 由化学方程式可知,反应Ⅲ的化学平衡常数K=c4(SO2),温度不变,平衡常数不变,则达到平衡时向容器中再充入少量SO2,重新平衡时,容器内二氧化硫的浓度和物质的量不变,故正确;
D. 达到平衡时向容器中再充入少量SO2,生成物浓度增大,平衡向逆反应方向移动,重新平衡时,CaSO4(s)的质量增大,CaS(s)的质量减小,故错误;
BC正确,故答案为:BC;
(4)在氢气流量高于242 mL·min-1时,导致氢气过量,反应生成的二氧化硫在过量氢气的作用下重新生成硫化钙和硫酸钙,导致分解率和脱硫率均降低,故答案为:生成的SO2在过量H2的作用下又重新生成CaS或CaSO4;
(5)反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=
CaSO4(s)的K'p=![]() =
=![]() =
=![]() ≈262,故答案为:262。
≈262,故答案为:262。

【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D