题目内容
已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数. 其中B1的沸点比B2高.
试回答下列问题:
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是 ; D2的电子式为: .
(2)写出B1转化为A1、C1的方程式: ;液态的B2与Na反应的方程式: .
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式 ,其中D1的作用是 ;
②利用①中原理制备出NaClO2?3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下(已知:I2+2S2O32ˉ=S4O62ˉ+2Iˉ):
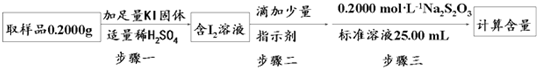
步骤一的离子方程式为 ;步骤二的指示剂是 ;步骤三中出现 现象时,达到滴定终点;计算该试样中NaClO2?3H2O的质量百分数为 .
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是
(2)写出B1转化为A1、C1的方程式:
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式
②利用①中原理制备出NaClO2?3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下(已知:I2+2S2O32ˉ=S4O62ˉ+2Iˉ):

步骤一的离子方程式为
分析:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C都是10电子,D为18电子,应是H与O或H与N形成的微粒,H与O形成的微粒A、B、C、D为分别为:OH-、H2O、H3O+、H2O2,H与N形成的微粒A、B、C、D为分别为:NH2-、NH3、NH4+、N2H4,B1的沸点比B2高,故B1为H2O,B2为NH3,故:
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)原子序数处在中间为N元素,N原子有2个电子层,最外层电子数为5,据此确定在元素周期表中的物质;
D2为N2H4,分子中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对;
(2)2mol水电离生成1molOH-、1molH3O+;Na与NH3(l)反应生成NaNH2、H2;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,碘遇淀粉变蓝色,加入淀粉作指示剂,进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;
令样品的纯度为a,则NaClO2?3H2O的质量质量为0.2ag,根据关系式列方程计算.
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)原子序数处在中间为N元素,N原子有2个电子层,最外层电子数为5,据此确定在元素周期表中的物质;
D2为N2H4,分子中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对;
(2)2mol水电离生成1molOH-、1molH3O+;Na与NH3(l)反应生成NaNH2、H2;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,碘遇淀粉变蓝色,加入淀粉作指示剂,进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;
令样品的纯度为a,则NaClO2?3H2O的质量质量为0.2ag,根据关系式列方程计算.
解答:解:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C都是10电子,D为18电子,应是H与O或H与N形成的微粒,H与O形成的微粒A、B、C、D为分别为:OH-、H2O、H3O+、H2O2,H与N形成的微粒A、B、C、D为分别为:NH2-、NH3、NH4+、N2H4,B1的沸点比B2高,故B1为H2O,B2为NH3,故:
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)原子序数处在中间为N元素,N原子有2个电子层,最外层电子数为5,处于周期表中第二周期第VA族,
D2为N2H4,分子中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对,N原子各有1对孤对电子对,电子式为: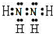 ,
,
故答案为:第二周期第VA族; ;
;
(2)2mol水电离生成1molOH-、1molH3O+,电离方程式为:2H2O?OH-+H3O+,
Na与NH3(l)反应生成NaNH2、H2,反应方程式为:2Na+2NH3(l)=2NaNH2+H2↑,
故答案为:2H2O?OH-+H3O+;2Na+2NH3(l)=2NaNH2+H2↑;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成,反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,反应中H2O2是还原剂,
故答案为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2;还原剂;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,ClO2-被还原为Cl-,同时生成H2O,反应离子方程式为:ClO2-+4I-+4H+=2I2+Cl-+2H2O,
碘遇淀粉变蓝色,加入淀粉作指示剂,
进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点,
令样品的纯度为a,则NaClO2?3H2O的质量质量为0.2ag,则:
NaClO2?3H2O~2I2~4S2O32ˉ
144.5g 4mol
0.2ag 0.2mol/L×0.025L
所以144.5g:0.2ag=4mol:0.2mol/L×0.025L
解得a=90.3%
故答案为:ClO2-+4I-+4H+=2I2+Cl-+2H2O;淀粉;溶液由蓝色变无色,且半分钟不变色现象;90.3%.
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)原子序数处在中间为N元素,N原子有2个电子层,最外层电子数为5,处于周期表中第二周期第VA族,
D2为N2H4,分子中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对,N原子各有1对孤对电子对,电子式为:
 ,
,故答案为:第二周期第VA族;
 ;
;(2)2mol水电离生成1molOH-、1molH3O+,电离方程式为:2H2O?OH-+H3O+,
Na与NH3(l)反应生成NaNH2、H2,反应方程式为:2Na+2NH3(l)=2NaNH2+H2↑,
故答案为:2H2O?OH-+H3O+;2Na+2NH3(l)=2NaNH2+H2↑;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成,反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,反应中H2O2是还原剂,
故答案为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2;还原剂;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,ClO2-被还原为Cl-,同时生成H2O,反应离子方程式为:ClO2-+4I-+4H+=2I2+Cl-+2H2O,
碘遇淀粉变蓝色,加入淀粉作指示剂,
进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点,
令样品的纯度为a,则NaClO2?3H2O的质量质量为0.2ag,则:
NaClO2?3H2O~2I2~4S2O32ˉ
144.5g 4mol
0.2ag 0.2mol/L×0.025L
所以144.5g:0.2ag=4mol:0.2mol/L×0.025L
解得a=90.3%
故答案为:ClO2-+4I-+4H+=2I2+Cl-+2H2O;淀粉;溶液由蓝色变无色,且半分钟不变色现象;90.3%.
点评:本题考查物质推断、化学用语、氧化还原反应滴定、化学计算等,难度较大,推断物质是解题的关键,注意掌握常见10电子、18电子微粒.

练习册系列答案
相关题目
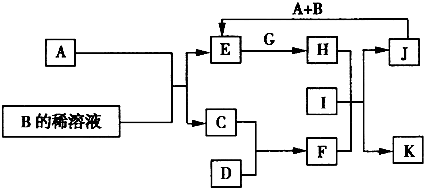
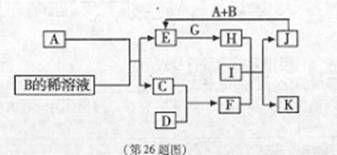
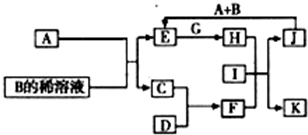 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.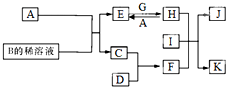 A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.