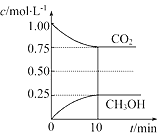
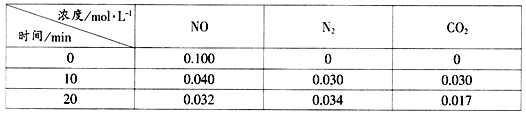
题目内容
【题目】亚硝酰氯((ClNO)是合成有机物的重要中间体,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
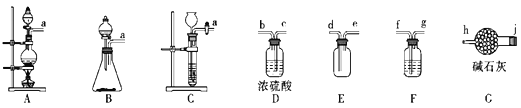
已知:1).亚硝酰氯沸点为-5.5℃,易水解,C1NO+H2O=HNO2+HCl;
2).AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3+HNO2。
(1)制备Cl2的发生装置可以选用__(填字母代号)装置,发生反应的离子方程式为__。
(2)欲收集一瓶干燥纯净的氯气,选择合适的装置,其连接顺序为a→__(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
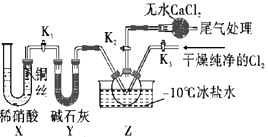
本实验利用X装置制备NO最主要的优点为__,装置中无水CaCl2的作用是__。
(4)通过以下实验测定C1NO样品的纯度。取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__,亚硝酰氯(ClNO)的质量分数为__。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-2)
【答案】A(或B) MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) f→g→c→b→d→e→j→h 随开随用,随关随停 防止水蒸气进入三颈烧瓶中与ClNO反应 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化
Mn2++Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) f→g→c→b→d→e→j→h 随开随用,随关随停 防止水蒸气进入三颈烧瓶中与ClNO反应 滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化 ![]() %
%
【解析】
(1)实验室制取氯气可以利用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,则发生装置可以选择上图中的A;反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,要进行尾气处理,可利用碱石灰作吸收剂进行尾气处理,故装置的连接顺序为a![]() f→g→c→b→d→e→j→h;
f→g→c→b→d→e→j→h;
(3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰,可以随开随用,随关随停;在检查完装置气密性,并装入药品后,打开k2,然后再打开k3,通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质;
(4) AgNO3标准溶液滴定至终点是,氯离子消耗完,再加生成Ag2CrO4为砖红色固体;取Z中所得液体mg溶于水, 25.00mL溶液中n(ClNO)=n(Cl-)=n(Ag+)=c mol/L![]() 20.00mL
20.00mL![]() 10-3L/mL=0.0200cmol,亚硝酰氯(ClNO)的质量分数为
10-3L/mL=0.0200cmol,亚硝酰氯(ClNO)的质量分数为![]() 。
。
(1)实验室制取氯气可以利用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,则发生装置可以选择上图中的A;反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;故答案为:A(或B);MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;故答案为:A(或B);MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O);
Mn2++Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O);
(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,要进行尾气处理,可利用碱石灰作吸收剂进行尾气处理,故装置的连接顺序为a![]() f→g→c→b→d→e→j→h,故答案为:f→g→c→b→d→e→j→h;
f→g→c→b→d→e→j→h,故答案为:f→g→c→b→d→e→j→h;
(3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰,可以随开随用,随关随停,故答案为:随开随用,随关随停;在检查完装置气密性,并装入药品后,打开k2,然后再打开k3,通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质,故答案为:防止水蒸气进入三颈烧瓶中与ClNO反应;
(4) AgNO3标准溶液滴定至终点是,氯离子消耗完,再加生成Ag2CrO4为砖红色固体,故答案为:滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化;取Z中所得液体mg溶于水, 25.00mL溶液中n(ClNO)=n(Cl-)=n(Ag+)=c mol/L![]() 20.00mL
20.00mL![]() 10-3L/mL=0.0200cmol,亚硝酰氯(ClNO)的质量分数为
10-3L/mL=0.0200cmol,亚硝酰氯(ClNO)的质量分数为![]() ,故答案为:
,故答案为:![]() %。
%。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
【题目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是两种重要的化工原料。
,是两种重要的化工原料。
(1)实验室制备![]() 的装置图(如图)和有关信息如下:
的装置图(如图)和有关信息如下:

物质 | 熔点/℃ | 沸点/℃ | 密度 | 性质 |
白磷 | 44.1 | 280.5 | 1.82 | 湿空气中约40℃着火 |
|
| 74.2 | 1.574 | 无色液体,遇水均剧烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①实验开始先打开![]() 通入
通入![]() 排除装置内空气的目的是______________________。
排除装置内空气的目的是______________________。
②实验制得的粗产品中含有![]() ,可用_______方法提纯。
,可用_______方法提纯。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他离子的浓度由大到小的顺序是___________________________________(已知
之外其他离子的浓度由大到小的顺序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)实验室通常用![]() 直接氧化
直接氧化![]() 制备
制备![]() ,工业上通常采用潮湿的
,工业上通常采用潮湿的![]() 氧化
氧化![]() 制备
制备![]() ,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
(3)用![]() 标准溶液定量测定实验室制备的
标准溶液定量测定实验室制备的![]() 粗产品的纯度,实验步骤如下:
粗产品的纯度,实验步骤如下:
①取![]() 粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入
粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入![]() 溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的
溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的![]() 纯度___________(填“偏大”“偏小”或“不变”)。[已知:
纯度___________(填“偏大”“偏小”或“不变”)。[已知:![]() ]
]
②滴加![]() 作指示剂,用
作指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 溶液,当溶液__________________________,即为终点。共用去
溶液,当溶液__________________________,即为终点。共用去![]() 溶液,则粗产品中
溶液,则粗产品中![]() 的纯度为_________%(保留小数点后1位)。
的纯度为_________%(保留小数点后1位)。