题目内容
14.关于小苏打溶液的表述正确的是( )| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
分析 A.碳酸氢钠溶液中存在物料守恒,n(Na)=n(C);
B.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
C.碳酸氢钠溶液显碱性,碳酸氢根离子水解程度大于电离程度;
D.碳酸氢钠溶液显碱性,碳酸氢根离子水解程度大于电离程度,据此分析溶液中离子浓度大小;
解答 解:A.碳酸氢钠溶液中存在物料守恒,c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B.溶液中存在电荷守恒,c (Na+)+c (H+)═c (HCO3-)+2c(CO32-)+c (OH-),故B错误;
C.碳酸氢钠溶液显碱性,HCO3- 的电离程度小于HCO3-的水解程度,故C错误;
D.碳酸氢钠溶液显碱性,碳酸氢根离子水解程度大于电离程度,离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、溶液中电荷守恒、物料守恒的计算应用,注意碳酸氢钠溶液显碱性的原因,题目较简单.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
5.化学与人类生活、社会可持续发展密切相关.下列有关叙述中不正确的是( )
| A. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 | |
| C. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 |
9.下列物质含有离子键但不含共价键的是( )
| A. | C12 | B. | CaCl2 | C. | NH4Cl | D. | HCl |
19.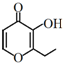 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
6.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | B. | H2O NH3•H2O HClO. | ||
| C. | H2SO3.Ba(OH)2BaSO4 | D. | Cu(OH)2CH3COOH CH3COONa |
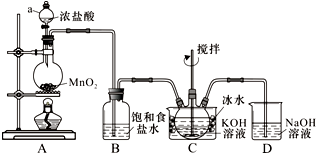 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.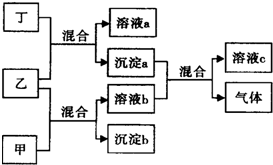 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):