题目内容
有pH=1的盐酸、硫酸、醋酸三瓶溶液(用>、<、=填空,下同).(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是 .
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是 .
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 .
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是 .
【答案】分析:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,所以盐酸溶液中C(H+)=C(HCl),硫酸溶液中C(H+)= (H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH);
(H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH);
(2)根据C= 中氢离子物质的量的变化确定所需水体积大小;
中氢离子物质的量的变化确定所需水体积大小;
(3)中和相同物质的量的氢氧化钡溶液,则需要酸中氢元素的物质的量相同;
(4)反应速率与氢离子浓度成正比.
解答:解:(1)氯化氢和硫酸是强电解质,则盐酸溶液中C(H+)=C(HCl),硫酸溶液中C(H+)= (H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH),pH相同的三种酸的物质的量浓度关系是C3>C1>C2;
(H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH),pH相同的三种酸的物质的量浓度关系是C3>C1>C2;
故答案为:C3>C1>C2;
(2)稀释前后,盐酸和硫酸溶液中氢离子的物质的量不变,醋酸溶液中氢离子的物质的量增大,结合C= 知,要使稀释后的溶液中pH仍相等,则需要水的体积大小关系是V3>V1=V2;
知,要使稀释后的溶液中pH仍相等,则需要水的体积大小关系是V3>V1=V2;
故答案为:V3>V1=V2;
(3)中和等物质的量的氢氧化钡溶液,则需要三种酸中提供的氢离子的物质的量相等,盐酸和醋酸是一元酸,硫酸是二元酸,要提供相同物质的量的氢离子,则盐酸和醋酸的物质的量相等,硫酸的物质的量是盐酸的一半即可,所以得n1=n3>n2,
故答案为:n1=n3>n2;
(4)pH=1的盐酸、硫酸、醋酸三种溶液中c(H+)=0.1mol/L,反应本质为Zn+2H+=Zn2++H2↑,氢离子浓度相同,故开始反应速率相同,即υ1=υ2=υ3,
故答案为:υ1=υ2=υ3.
点评:本题考查了弱电解质的电离平衡、影响反应速率的因素等知识点,注意(4)题中酸和锌反应的反应速率与氢离子浓度成正比,为易错点.
 (H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH);
(H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH);(2)根据C=
 中氢离子物质的量的变化确定所需水体积大小;
中氢离子物质的量的变化确定所需水体积大小;(3)中和相同物质的量的氢氧化钡溶液,则需要酸中氢元素的物质的量相同;
(4)反应速率与氢离子浓度成正比.
解答:解:(1)氯化氢和硫酸是强电解质,则盐酸溶液中C(H+)=C(HCl),硫酸溶液中C(H+)=
 (H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH),pH相同的三种酸的物质的量浓度关系是C3>C1>C2;
(H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH),pH相同的三种酸的物质的量浓度关系是C3>C1>C2;故答案为:C3>C1>C2;
(2)稀释前后,盐酸和硫酸溶液中氢离子的物质的量不变,醋酸溶液中氢离子的物质的量增大,结合C=
 知,要使稀释后的溶液中pH仍相等,则需要水的体积大小关系是V3>V1=V2;
知,要使稀释后的溶液中pH仍相等,则需要水的体积大小关系是V3>V1=V2;故答案为:V3>V1=V2;
(3)中和等物质的量的氢氧化钡溶液,则需要三种酸中提供的氢离子的物质的量相等,盐酸和醋酸是一元酸,硫酸是二元酸,要提供相同物质的量的氢离子,则盐酸和醋酸的物质的量相等,硫酸的物质的量是盐酸的一半即可,所以得n1=n3>n2,
故答案为:n1=n3>n2;
(4)pH=1的盐酸、硫酸、醋酸三种溶液中c(H+)=0.1mol/L,反应本质为Zn+2H+=Zn2++H2↑,氢离子浓度相同,故开始反应速率相同,即υ1=υ2=υ3,
故答案为:υ1=υ2=υ3.
点评:本题考查了弱电解质的电离平衡、影响反应速率的因素等知识点,注意(4)题中酸和锌反应的反应速率与氢离子浓度成正比,为易错点.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
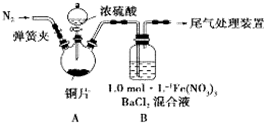 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
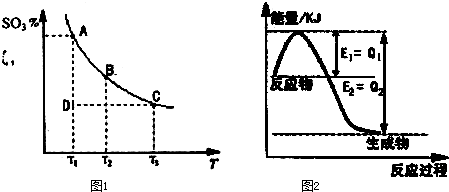
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究. 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):



 ①
① (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。