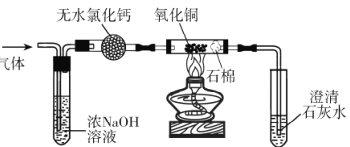
题目内容
【题目】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及 氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为 ____
(2)单质X的化学式是_______,吸收塔中X的作用是 ____。
(3)工业上为了储运浓硝酸,最好选择____作为罐体材料。
A.铜 B.铂 C.铝 D.镁
(4)为避免硝酸生产尾气中的氮氧化物污染环境,工业上常用Na2CO3吸收尾气,发生 的反应为:NO+NO2+Na2CO3=2NaNO2+CO2、2NO2+Na2CO3=NaNO2 + NaNO3+CO2,将标准状况下44.8 L仅含NO和NO2混合气体的尾气通入Na2CO3溶液中,尾气被 完全吸收,则消耗的Na2CO3的物质的量为_____mol。
【答案】3H2+N2![]() 2NH3 O2 将氮氧化物充分氧化为HNO3 C 1
2NH3 O2 将氮氧化物充分氧化为HNO3 C 1
【解析】
(1)氮气和氢气在合成塔中生成氨气;
(2)氧化炉中氨气催化氧化得到一氧化氮,吸收塔中一氧化氮被氧气氧化为二氧化氮,二氧化氮和水反应可以得到硝酸;
(3)硝酸具有强氧化性,能氧化除金、铂以外的大多数金属,常温下,铁、铝在浓硝酸中钝化而阻止进一步被氧化;
(4)由方程式可知Na2CO3溶液与NO和NO2反应生成NaNO2和NaNO3混合液,由N原子和Na原子个数守恒计算可得。
(1)氮气和氢气在合成塔中生成氨气,反应的化学方程式为3H2+N2![]() 2NH3,故答案为:3H2+N2
2NH3,故答案为:3H2+N2![]() 2NH3;
2NH3;
(2)氧化炉中氨气催化氧化得到一氧化氮,吸收塔中一氧化氮被氧气氧化为二氧化氮,二氧化氮和水反应可以得到硝酸,则X为氧气,吸收塔中氧气的作用是将氮氧化物充分氧化为HNO3,故答案为:O2;将氮氧化物充分氧化为HNO3;
(3)硝酸具有强氧化性,能氧化除金、铂以外的大多数金属,常温下,铁、铝在浓硝酸中钝化而阻止进一步被氧化,由于铂是贵重金属,所以工业上为了储运浓硝酸最好选择铝作为罐体材料,故答案为:C;
(4)44.8 L NO和NO2混合气体的物质的量为![]() =2mol,由N原子个数守恒可知,NaNO2和NaNO3的物质的量之和为2mol,由Na原子个数守恒可知,消耗Na2CO3的物质的量为2mol×
=2mol,由N原子个数守恒可知,NaNO2和NaNO3的物质的量之和为2mol,由Na原子个数守恒可知,消耗Na2CO3的物质的量为2mol×![]() =1mol,故答案为:1.
=1mol,故答案为:1.

 智慧小复习系列答案
智慧小复习系列答案【题目】已知反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
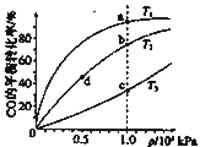
A.平横常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D.平均相对分子质量:M(a)=M(c),M(b)>M(d)