题目内容
对于某酸性溶液(可能含有Br -、SO42-、H2SO3、NH4+),分别进行如下实验对于下列物质不能确定其在原溶液中是否存在的是( )
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀.
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀.
| A、Br - |
| B、SO42- |
| C、H2SO3 |
| D、NH4+ |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:二氧化硫气体可以使品红溶液褪色,氨气能使湿润的红色石蕊试纸变蓝,硫酸钡是不溶于硝酸的白色沉淀,以此解答该题.
解答:
解:(1)加热,放出的气体可以使品红溶液褪色,证明其中含有H2SO3;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
(3)取原溶液加氯水,溶液略显橙红色,则含有溴离子,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认硫酸根在原溶液中是否存在.
故选B.
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
(3)取原溶液加氯水,溶液略显橙红色,则含有溴离子,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认硫酸根在原溶液中是否存在.
故选B.
点评:本题考查常见阴离子的检验,为高频考点,侧重于学生的分析能力的考查,难度不大,注意掌握常见阴离子的检验方法,并会设计合理的实验.

练习册系列答案
相关题目
将15.6g Na2O2与5.4g Al同时放入一定量的水中,充分溶解后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液体积不变,则下列说法正确的是( )
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、MnO2CuO FeO |
| B、Na2CO3CaCO3 K2CO3 |
| C、AgNO3KNO3 Na2CO3 |
| D、(NH4)2SO4 K2SO4 NH4Cl |
两种气态烃以任意比例混合,在150℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中不符合此条件的是( )
| A、CH4 C2H4 |
| B、CH4 C3H6 |
| C、C2H4 C3H4 |
| D、CH4 C3H4 |
已知X、Y是主族元素,I为电离能,单位是kJ/mol.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11575 |
| A、元素X的常见化合价是+1 |
| B、元素Y是ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、若元素Y处于第3周期,它可与冷水剧烈反应 |
化学与生活、社会密切相关.下列说法错误的是( )
| A、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 |
| B、含磷洗衣粉中的磷是植物生长的营养元素,洗衣水可排入河泊 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、国家规定商家不得无偿提供塑料袋,是为了减少白色污染 |
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.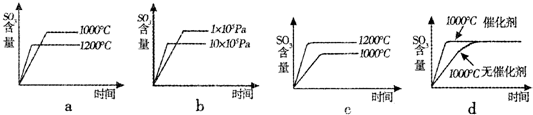
 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )