��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2) �ڴ����������ºϳɼ״�������������Ӧ����:
��CO(g)+2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-58kJ/mol
CH3OH(g)+H2O(g) ��H=-58kJ/mol
��CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H=+41kJ/mol
CO(g)+H2O(g) ��H=+41kJ/mol
�ش���������:
(1)��֪��Ӧ���е���صĻ�ѧ��������������:
��ѧ�� | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
��x=______�����ú�������ĸ�Ĵ���ʽ��ʾ��
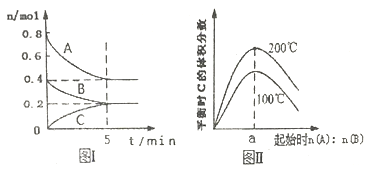
(2)����lmolCO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�ڡ����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK��_____K��(�>��=����<��)
��һ���¶���,���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______��
a.������ѹǿ����
b.�״���ˮ����������ȱ��ֲ���
c.v��(H2)=3v��(CH3OH)
d.2��C=O���ѵ�ͬʱ��3��H-H�γ�
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_____�����¶��µ�ƽ�ⳣ��Ϊ_____���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���____��
a.�����¶� b.ʹ�ú��ʵĴ��� c.����He d.��ԭ�����ٳ���CO2��H2
���𰸡� 1/3(2a+c-b-d)+33 > a��c��d 0.06mol/(L��min) 450 d
��������(1)���ݸ�˹�����У����̢�=���̢�-���̢ۣ�������H1=-58kJ/mol-��+41kJ/mol��=-99 kJ/mol
��������H1=��Ӧ����ܼ���-��������ܼ���=��c+2a��-(3x+b+d)������x= 1/3(2a+c-b-d)+33��
(2) �١����ߢ��ȴﵽƽ�⣬���Ԣ��Ӧ���¶ȱȢ���¶ȸߣ����ڷ�ӦCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-58KJ/mol��˵������ƽ�������ƶ���ƽ�ⳣ������K��>K����
CH3OH(g)+H2O(g) ��H=-58KJ/mol��˵������ƽ�������ƶ���ƽ�ⳣ������K��>K����
�ڡ��÷�Ӧ��������Ӹ���ǰ�����仯��������ѹǿ���䣬˵������ķ��Ӹ������ٱ仯������˵����Ӧ�Ѵ�ƽ�⣬a��ȷ�������ʼͶ�����ʼԭ��ֻ�з�Ӧ���ֻ���������Ұ���ѧ������Ͷ�ϣ���Ӧ�м״���ˮ�����������ʼ����һ����ֵ����˵����Ӧ�Ƿ�ƽ�⣬b����v��(H2)=3v��(CH3OH)������Ӧ�Ѵ�ƽ������v��(H2)= v��(H2)������v��(H2)=3v��(CH3OH)��˵����Ӧ�Ѵ�ƽ�⣬c��ȷ��2��C=O���ѵ�ͬʱ��3��H-H�γɣ��������ʷ����෴���ҷ��ϻ�ѧ������֮�ȣ�����˵���Ѵ�ƽ�⣬d��ȷ�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����a��c��d��
����5minʱv(H2)=2mol��0.9��2L��5min=0.18 mol/(L��min)������v(CO2)= v(H2)/3=0.06 mol/(L��min)����������ģʽ��������õ�ƽ��ʱCO2��H2��CH3OH��H2O��Ũ�ȷֱ�Ϊ��0.2mol/L��0.1mol/L��0.3mol/L��0.3mol/L������K=(0.3��0.3)/(0.2��0.13)=450�����£�ƽ�������ƶ����״����ʽ��ͣ�������Ӱ��ƽ����ƶ����Լ״��IJ�����Ӱ�죻���������³���He����Ӧ��ϵ�и����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����Լ״��IJ�����Ӱ�죻��ԭ�����ٳ���CO2��H2���൱���ڵ�Чƽ��Ļ�������ѹ��ƽ�������ƶ����״��IJ�������ѡ��d��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�����Ŀ������ͼʾװ�ý�������ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
��Һa | ����b | ��Һc | ʵ��Ŀ�ģ���֤ |
| |
A | Ũ���� | NaHCO3 | Na2SiO3 | �ǽ����ԣ�N��C��Si | |
B | Ũ���� | KMnO4 | Na2S | �����ԣ�KMnO4��Cl2��S | |
C | Ũ���� | CaCO3 | NaAlO2 | ���ԣ�HCl��H2CO3��Al(OH)3 | |
D | Ũ��ˮ | CaO | ��̪��Һ | NH3��H2O������ |
A. A B. B C. C D. D
����Ŀ��CuCl���л��ϳɵ���Ҫ���������������ϡ������ȹ�ҵ����ҵ���ɷ�ͭ�ϣ���Fe��Al���仯���SiO2���ʣ�������CuCl�Ĺ����������£�
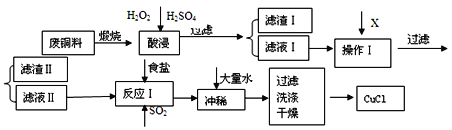
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
��֪��CuCl����NaCl��Ũ��Һ������CuCl2-��CuCl2-����Һ��ˮϡ�ͺ������CuCl������
��1�����յ���ҪĿ������______________________________________��
��2��������Ϊ������Һ��pHֵ����ΧΪ___________�����������X������_________________________ ��
A.CuO B.Cu(OH)2 C .NaOH ��Һ D.CaCO3
��3������I����Ҫ�ɷ���________�����������Ҫ�ɷ���_________��
��4������Һ���м���ʳ�β�ͨ��SO2������CuCl����д����Ӧ�����ӷ���ʽ________________________________________________________________________________________ ��
��5���ڷ�Ӧ���У����Ȳ�ʹ��ŨNaC1��Һ����ҪĿ����_____________________________________________________________________________________ ��