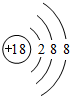
题目内容
某元素的原子M层有3个电子,写出它的氧化物的电子式。将10.2g这种氧化物与7mol×L-l的盐酸100mL反应后,再滴入1mol×L-1的NaOH溶液800mL后,得到多少克沉淀?
答案:
解析:
解析:
解: 发生的反应为:Al2O3+6HCl═2AlCl3+3H2O NaOH+HCl═NaCl+H2O AlCl3+3NaOH═Al(OH)3↓+3NaCl
Al(OH)3+NaOH═NaAlO2+2H2O ④ ③+④得:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
已知:n(Al2O3)=
n(HCl)=0.1L´7mol×L-1=0.7mol n(NaOH)=0.8L´1mol×L-1=0.8mol 与盐酸反应后,根据Al原子守恒得到 n(AlCl3)=0.1mol´2=0.2mol 剩余的NaOH为: n(NaOH)=0.8mol-(0.7mol-0.1mol´6)=0.7mol 溶液中
∴ 生成的n[Al(OH)3]=4n(Al3+)-n(OH-) =4´0.2mol-0.7mol =0.1mol 产生沉淀m[Al(OH)3]=0.1mol´78g×mol-1=7.8g
|

练习册系列答案
相关题目