题目内容
13. 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.(1)滴定:①用酸式滴定管盛装1.00mol/L盐酸标准液.如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准盐酸的体积填入③表空格中.滴定管中剩余液体的体积大于.0.10mL(填大于、小于或者等于).
②下表是3种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 8.2-10.0 |
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20 | 0.50 | 25.12 | 24.62 |
| 2 | 20 | 如图 | 如图 | 填写24.60 |
| 3 | 20 | 6.00 | 30.58 | 24.58 |
(3)下列几种情况会使测定结果偏高的是ce
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定.
e.未用标准液润洗酸式滴定管.
分析 (1)①根据酸性溶液存放在酸式滴定管中;根据滴定管的结构以及测量体积的原理来分析;
②石蕊的颜色变化不明显,不能作指示剂;使用酚酞做指示剂,酸滴碱,溶液由浅红色变无色;
③根据图中的数据分析;
(2)先考虑数据的合理性,然后求体积的平均值,然后根据c(待测)=$\frac{C(标准)×C(标准)}{C(待测)}$计算;
(3)根据c(待测)=$\frac{C(标准)×C(标准)}{C(待测)}$分析误差.
解答 解:(1)①盐酸是酸性溶液,存放在酸式滴定管中;滴定管的最大刻度下面有一段高度无刻度,所以滴定管中能盛放的液体的体积大于其量程,则滴定管中剩余液体的体积大于0.10mL;
故答案为:酸;大于;
②石蕊的颜色变化不明显,不能作指示剂,所以中和滴定时不能选用石蕊作指示剂;使用酚酞做指示剂,酸滴碱,溶液由浅红色变无色,则滴入最后一滴,溶液由浅红色变为无色,且半分钟内不恢复即达到滴定终点;
故答案为:石蕊;滴入最后一滴,溶液由浅红色变为无色,且半分钟内不恢复;
③滴定前读数为0.30mL,滴定后读数为24.90mL,则消耗溶液的体积为24.60mL,故答案为:24.60;
(2)由第1组、第2组、第3组消耗的盐酸标准液的体积为:$\frac{24.62+24.60+24.58}{3}$mL=24.60mL,c(待测)=$\frac{C(标准)×C(标准)}{C(待测)}$=$\frac{1.000×0.02460}{0.0200}$mol/L=1.23mol/L,
故答案为:1.23;
(3)a.若滴定前用蒸馏水冲洗锥形瓶,锥形瓶中待测物的物质的量不变,所以消耗的标准液体积不变,所以测定结果不变,故a错误;
b.滴定后俯视读数,则消耗的标准液体积偏小,所以测定结果偏小,故b错误;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗的标准液体积偏大,测定结果偏高,故c正确;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定,则标准溶液的用量偏少,即消耗的标准液体积偏小,故d错误;
e.未用标准液润洗酸式滴定管,滴定管中有蒸馏水,所以标准溶液的浓度减小,滴定时消耗的标准溶液的体积偏大,则测定结果偏高,故e正确.
故答案为:ce.
点评 本题主要考查了中和滴定操作、数据处理以及注意事项,难度不大,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

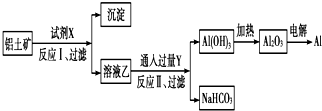
对上述流程中的判断不正确的是( )
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
(1)甲同学首先进行了实验1.
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴(1滴约为0.05mL,下同). | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液不显红色. |
②加入KSCN溶液的目的是检验溶液中是否大量存在Fe3+.
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
| 实验 2 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴. | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液显红色. | |
| ⅲ.继续加入2mL CCl4,充分振荡、静置. | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色. |
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-.于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-.
①为验证假设,乙同学设计并完成了实验3.
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ.取1mL实验2中棕黄色的上层清液,再加入2mL CCl4,振荡、静置. | ⅰ.液体分层,上层呈黄色,下层呈紫红色. | |
| ⅱ.取1mL饱和碘水,加入2mL CCl4,振荡、静置. | ⅱ.液体分层,上层为无色,下层呈紫红色. |
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-?I3-的存在.
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1mL水,振荡、静置;向试管2中加入1mL0.1mol•L-1KI溶液,振荡、静置.
两支试管中的现象分别为试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,下层呈紫红色(或紫红色变浅).
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应 | |
| C. | 乙酸乙酯和油脂在一定条件下都能水解 | |
| D. | 所有烷烃中都存在碳碳单键 |



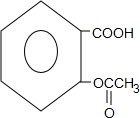 +3NaOH→
+3NaOH→ +CH3COONa+2H2O.
+CH3COONa+2H2O. 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.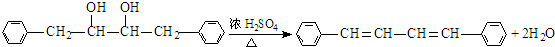 .
.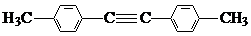
 溶液中的离子反应
溶液中的离子反应 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题: 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.