题目内容
酸碱恰好完全中和时( )
| A.酸与碱的物质的量一定相等 |
| B.溶液呈现中性 |
| C.酸与碱的物质的量浓度相等 |
| D.酸所能提供的H+与碱所能提供的OH-的物质的量相等 |
D
解析

练习册系列答案
相关题目
常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是
| A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-) |
| B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+) |
| D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-) |
下列说法正确的是( )
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+) |
| C.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-) |
| D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列说法正确的是
| A.c(H+)>c(OH一)的溶液一定显酸性 |
| B.常温下,pH=6的溶液一定是酸溶液 |
| C.电解稀硫酸或氢氧化钠溶液的产物不同 |
| D.水电解生成氢气和氧气,证明水是弱电解质 |
[双选题]为了配制NH 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
| A.适量的HCl | B.通适量氨气 |
| C.适量的氨水 | D.适量的NaOH |
下列各步制取物质,最终无法达到目的的有( )
A.Al Al2O3 Al2O3 Al(NO3)3 Al(NO3)3 Al2O3 Al2O3 |
B.Cu CuO CuO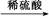 CuSO4溶液 CuSO4溶液 CuSO4·5H2O CuSO4·5H2O |
C.Fe FeCl3 FeCl3 Fe(OH)3 Fe(OH)3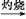 Fe2O3 Fe2O3 |
D.FeSO4溶液 FeS FeS FeS FeS |
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
| A.22.30 mL | B.22.35 mL | C.23.65 mL | D.23.70 mL |
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.①②⑤ | D.全部 |
下列关于强、弱电解质的叙述中正确的是( )
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 |
| D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱 |