��Ŀ����
��13�֣�(1)1g̼������ˮ������Ӧ����CO��H2��������10.94KJ�������Ȼ�ѧ����ʽΪ
(2)��֪��1��105 Pa��298 K�����£�2 mol����ȼ������Һ̬ˮ�ų�571.6kJ����������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
��3��Na2CO3����Һ���ܴ����ĥ�ڲ��������Լ�ƿ�У���ԭ���ǣ�������ӷ���ʽ˵������ �������Ȼ�����Һ���ɲ��������,���õ��Ĺ�������ǣ���ѧʽ�� ����ط�Ӧ�ķ���ʽ�ǣ� �� ������FeCl2��Һʱ��Ӧ���� ��������Fe2+��ˮ�⣬��Ӧ�����������ۣ�Ŀ���ǣ� ��
(1) C(s)+ H2O(g) == CO(g) + H2(g)��H== +131.3KJ��mol��1
(2) H2(g)��O2(g)===H2O(l)����H��-285.6 kJ��mol��1
��3��CO32-��H2O HCO3��+OH-���������˵������Fe2O3��
HCO3��+OH-���������˵������Fe2O3��
Fe3+ + 3H2O Fe��OH��3 + 3H+��2Fe��OH��3=��=Fe2O3+3H2O�� ��� ��ֹFe2+��������
Fe��OH��3 + 3H+��2Fe��OH��3=��=Fe2O3+3H2O�� ��� ��ֹFe2+��������
����

 ��ǰ����ϵ�д�
��ǰ����ϵ�д���11�֣���������ı�����Ԫ��֮һ���ӵ�ʳ���м������ĵ������һ�ְ�ɫ�ᾧ��ĩ�������º��ȶ��������������µ������һ�ֽ�ǿ��������������⻯��Ȼ�ԭ�����ʷ�Ӧ��
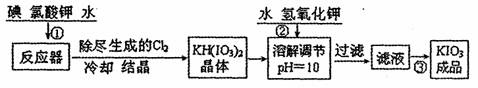
I����ҵ������̼�ص��������£�
|
��֪����ٷ�����ӦΪ6I2+11KclO3+3H2O=6KH��IO3��2+5KCl+3Cl2��
��Ӧ�л�ԭ���� ���ѧʽ����ת�Ƶ�����Ϊ ��
II����֪��KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
��1������ӵ�ʳ���еĵ�Ԫ�ء�
ѧ�������õ�����⻯�������������·�����Ӧ�������Ƿ��еⵥ����������Ҫ���Լ��� ���жϵⵥ�ʴ��ڵ������� ����Ҫ��һ�������ᴿ�ⵥ�ʣ��õ�����Ҫ���������� ��
��2���ⶨ�ӵ�ʳ���е�ĺ�����ѧ������Ƶ�ʵ�鲽�����£�
a.ȷ��ȡwgʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b.��ϡ�����ữ������Һ���������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��
c.�Ե���Ϊָʾ������μ������ʵ���Ũ��Ϊ2.0��10-3mol/L��Ns2S2O3��Һ10.0mL��ǡ����ȫ��Ӧ��I2+2S2O2-3=2I-+S4O2-6������ӵ�ʳ����Ʒ�еĵ�Ԫ�غ����� mg./kg���Ժ�w�Ĵ���ʽ��ʾ����
��3��������Ϊ�����õ⻯�ش���ʳ���еĵ���أ�ѧ�����ֽ���������ʵ�飺
| �������� | ʵ������ |
| ȡ1g������NaCl����3mLˮ�����Һ�� | ��Һ�ޱ仯 |
| ����5�ε�����Һ��1ml0.1mol/L KI��Һ���� | ��Һ�ޱ仯 |
| Ȼ���ټ�������ʳ�ף��� | ��Һ����ɫ |
����ѧ������ʵ�������ش���������
������Ϊ�ܷ��õ⻯�ش���ʳ���еĵ���� ����ܡ����ܻ�ȷ������������Ϊѧ���ҵ�ʵ���� ���ƫ�ߡ�ƫ�͡���Ӱ�족����