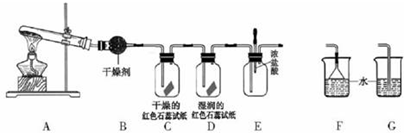
题目内容
16.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.碘、干冰都是分子晶体,升华变为气体均克服分子间作用力,故A正确;
B.干冰是分子晶体,变为气体时克服分子间作用力,氯化铵是离子晶体,克服离子键,故B错误;
C.二氧化硅是原子晶体,铁是金属晶体,克服作用力分别为共价键、金属键,故C错误;
D.食盐是离子晶体,葡萄糖是分子晶体,克服作用力分别为离子键、分子间作用力,故D错误;
故选A.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.

练习册系列答案
相关题目
17.下列叙述中,正确的是( )
| A. | 光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是Si | |
| B. | 二氧化碳不宜用于扑灭金属钠燃烧引起的火灾 | |
| C. | 一定条件下,可将石墨转化为金刚石,这一变化是物理变化 | |
| D. | 氢气作为新型燃料,其突出的优点是氢气轻,便于携带 |
18.鉴别溶液和胶体的最简便方法是( )
| A. | 电解 | B. | 电泳 | C. | 丁达尔现象 | D. | 用显微镜观察 |
1.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1L0.1mol•L-1的氨水中含有0.1NA个NH4+ | |
| C. | 1molNa被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温常压下,8gO2含有4NA个电子 |
8.氯元素的天然同位素有35Cl 和37Cl.氯元素的相对原子质量为35.45,则天然氯元素中35Cl 和37Cl的原子数目之比约为( )
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
6.X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是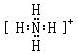 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是
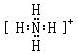 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.