题目内容
| |||||||||||
答案:
解析:
解析:
(1) |
0.8 mol·L-1·min-1 (2)50% 解析:(1)v(CH3OH)= 根据反应的速率比等于化学方程式的化学计量数比,得v(H2)=2v(CH3OH)=0.4 mol·L-1·min-1×2=0.8 mol·L-1·min-1。 |
(2) |
反应消耗的n(CO)=n(CH3OH)=2 mol·L-1×0.5 L=1 mol。 CO的转化率= |

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.现将1mol N2(g),3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为ω,下列说法中正确的是( )
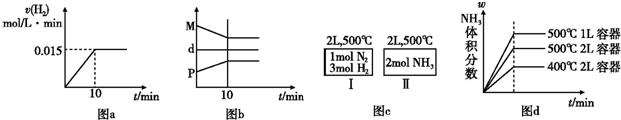

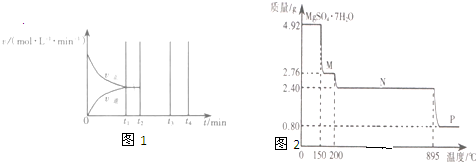
| A、若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示 | B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图b | C、如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ | D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示 |
合成氨的热化学方程式为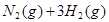
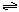

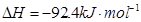 。现
。现
将1mol 3mol
3mol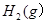 充入一容积为2L的密闭容器中,在500℃下进行反应,10min
充入一容积为2L的密闭容器中,在500℃下进行反应,10min
时达到平衡,NH3的体积分数为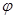 ,下列说法中正确的是( )
,下列说法中正确的是( )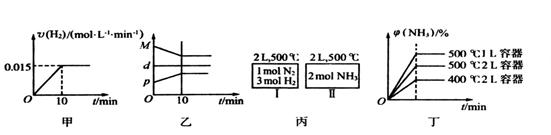
| A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为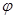 ,则容器I放出热量与容器II吸收热量之和为92.4kJ ,则容器I放出热量与容器II吸收热量之和为92.4kJ |
| D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |

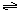
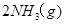
 。现
。现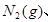 3mol
3mol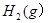 充入一容积为2L的密闭容器中,在500℃下进行反应,10min
充入一容积为2L的密闭容器中,在500℃下进行反应,10min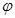 ,下列说法中正确的是( )
,下列说法中正确的是( )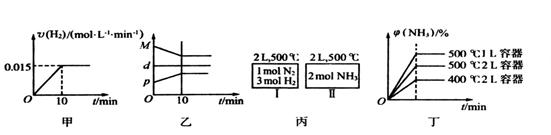
 2NH3(g);△H=-92.4kJ/mol现将1 molN2(g),3 mol H2(g)充入一容积为2L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分为ω,下列说法中正确的是
2NH3(g);△H=-92.4kJ/mol现将1 molN2(g),3 mol H2(g)充入一容积为2L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分为ω,下列说法中正确的是 