题目内容
实验室欲配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的是( )
| A、Na+、Mg2+、SO42-、Cl- |
| B、ClO-、I-、NH4+、Ba2+ |
| C、Na+、AlO2-、K+、HCO3- |
| D、Al3+、K+、SO42-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,说明离子在溶液中能够大量共存,且溶液中阴离子与阳离子所带的电荷数一定相等,据此进行判断.
解答:
解:根据题中信息可知,配制的溶液中四种离子能够大量共存,且阴阳离子所带的电荷总数相等,
A、Na+、Mg2+、SO42-、Cl-离子之间不发生反应,在溶液中能够共存,且溶液中四种离子的浓度均相等时满足溶液电中性,故A正确;
B、ClO-具有强氧化性,能够氧化I-离子,在配制的溶液中不能大量共存,故B错误;
C、AlO2-、HCO3-离子能够发生双水解反应,在配制的溶液中不能大量共存,故C错误;
D、Al3+、K+、SO42-、NO3-离子能够大量共存,但四种离子的浓度均相等时,不满足溶液电中性,故D错误;
故选A.
A、Na+、Mg2+、SO42-、Cl-离子之间不发生反应,在溶液中能够共存,且溶液中四种离子的浓度均相等时满足溶液电中性,故A正确;
B、ClO-具有强氧化性,能够氧化I-离子,在配制的溶液中不能大量共存,故B错误;
C、AlO2-、HCO3-离子能够发生双水解反应,在配制的溶液中不能大量共存,故C错误;
D、Al3+、K+、SO42-、NO3-离子能够大量共存,但四种离子的浓度均相等时,不满足溶液电中性,故D错误;
故选A.
点评:本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子反应发生的条件,解题关键是明确“溶液中四种离子的浓度均相等”的含义.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列有关实验原理或操作正确的是( )
A、 在溶液中将滴管内空气挤出后,再吸取溶液 |
B、 用排水法收集少量二氧化氮 |
C、 读取量筒内液体的体积 |
D、 在实验室制取少量的氨气 |
PM 2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺颗粒物,下列对PM2.5无影响的是( )
| A、风力发电 | B、汽车尾气 |
| C、煤炭燃烧 | D、建筑扬尘 |
下列解释事实的化学方程式或离子方程式,不正确的是( )
| A、工业上可用电解法制备Mg:MgCl2(熔融)═Mg+Cl2↑ |
| B、向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物与氧气充分反应,转移的电子数为0.3NA |
| C、一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
利用如图装置,可完成很多电化学实验.下列有关叙述,正确的是( )
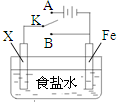

| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |


 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件)
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件)