题目内容
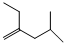
18.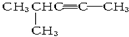 分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.
分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.
分析 根据该有机物的结构简式特点计算出分子式或者数出C和H的个数即可,依据炔烃命名方法进行命名,然后计算出完全燃烧消耗的氧气的物质的量.
解答 解: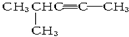 该有机物中分子式为C6H10,含有三键,为炔烃,含有三键的最长碳链5个C,主链为戊炔,三键在2、3号碳之间,编号从距离三键最近的一端开始,在4号碳上含有1个甲基,正确命名为:4-甲基-2-戊炔;1mol该有机物完全燃烧消耗的氧气的物质的量为:(6+$\frac{10}{4}$)mol=8.5mol,
该有机物中分子式为C6H10,含有三键,为炔烃,含有三键的最长碳链5个C,主链为戊炔,三键在2、3号碳之间,编号从距离三键最近的一端开始,在4号碳上含有1个甲基,正确命名为:4-甲基-2-戊炔;1mol该有机物完全燃烧消耗的氧气的物质的量为:(6+$\frac{10}{4}$)mol=8.5mol,
故答案为:C6H10;4-甲基-2-戊炔;8.5.
点评 本题考查了有机物分子式的确定、有机物的命名、有机物燃烧耗氧量等,题目难度不大.

练习册系列答案
相关题目
8.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
6.有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 丙酮的分子式C3H6O | ||
| C. | 四氯化碳的电子式为: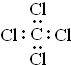 | D. | 乙醇的结构简式C2H6O |
10.已知:①钾比水轻;②钾的熔点低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性.某学生将一块金属钾投入滴有酚酞试液的水中,该实验能证明四点性质中的( )
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
7.下列过程不能同时生成两种盐的是( )
| A. | FeCl3溶液溶解铜 | B. | NaOH溶液吸收Cl2 | C. | Fe3O4与盐酸反应 | D. | CuCl2与Zn反应 |
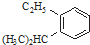 的炔烃的结构简式
的炔烃的结构简式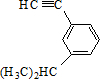 ;
; ;
; .
.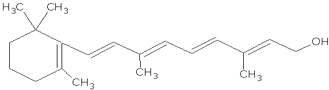 1mol维生素A最多能与5mol溴发生加成反应.
1mol维生素A最多能与5mol溴发生加成反应.