题目内容
下列实验合理的是( )
 |
 |
 |
 |
| A、证明非金属性Cl>C>Si | B、吸收氨气,并防止倒吸 | C、制备并收集少量NO2气体 | D、制备少量氧气 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,非金属在元素周期表中的位置及其性质递变的规律,常见气体制备原理及装置选择,氨的制取和性质
专题:实验评价题
分析:A.盐酸挥发,与硅酸钠反应生成硅酸沉淀;
B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离;
C.二氧化氮与水反应;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离.
B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离;
C.二氧化氮与水反应;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离.
解答:
解:A.盐酸挥发,与硅酸钠反应生成硅酸沉淀,图中装置不能说明碳酸的酸性大于硅酸,则不能比较非金属性,故A错误;
B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离,从而可防止倒吸,故B正确;
C.二氧化氮与水反应,不能利用排水法收集,故C错误;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误;
故选B.
B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离,从而可防止倒吸,故B正确;
C.二氧化氮与水反应,不能利用排水法收集,故C错误;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误;
故选B.
点评:本题考查化学实验方案的评价,涉及非金属性比较、倒吸装置、气体的制备及简易装置等,为高频考点,把握反应原理及装置图为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列各组中互为同位素的是( )
| A、O2和O3 |
| B、1H 和 2H |
| C、H2O和H2O2 |
| D、O2-和O |
用价层电子对互斥理论预测H2O和CH4的立体结构两个结论都正确的是( )
| A、直线形,三角锥形 |
| B、V形,三角锥形 |
| C、直线形,正四面体形 |
| D、V形,正四面体形 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1L水所含分子数为
4NA
⑦17g氨气所含电子数目为10NA.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1L水所含分子数为
| 1 |
| 22 |
⑦17g氨气所含电子数目为10NA.
| A、①②⑤⑥⑦ | B、①②④⑤⑥ |
| C、⑤⑦ | D、④⑤⑦ |
下列氧化物不属于酸性氧化物的是( )
| A、SiO2 |
| B、Mn2O7 |
| C、CO |
| D、N2O5 |
下列化合物中,常温下能被空气氧化的是( )
A、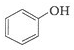 |
B、 |
C、 |
| D、CH4 |
实验室制取少量N2的反应是NaNO2+NH4Cl═NaCl+N2↑+2H2O,下列说法正确的是( )
| A、NaNO2是氧化剂 |
| B、NH4Cl发生还原反应 |
| C、生成1mol的 N2转移3mol的电子 |
| D、NaNO2在反应中失电子 |
可以用H++OH-=H2O来表示的离子反应是( )
| A、碳酸氢钠溶液和烧碱反应 |
| B、醋酸和氢氧化钾溶液反应 |
| C、硫酸氢钠溶液与苛性钾溶液反应 |
| D、稀硫酸和氨水反应 |