题目内容
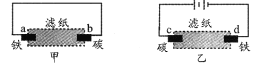
【题目】下图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,b为阴极。同时a、d电极上产生气泡。试回答

(1)a连接电源的___极。b极的电极反应式为______。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:___________。此时C极上的电极反应式为:_________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上的电极反应式为___________,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 ______ 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为____________?
【答案】正 M++e-=M C电极周围先变蓝色 2I--2e-=I2 4OH--4e-=O2↑+2H2O 108g/mol 0.12mol/L
【解析】
因为b为阴极,故a为阳极,c为阳极,d为阴极;a极产生氧气,c极产生I2,d极产生氢气。
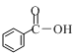
(1)因为b为阴极,故a为阳极,所以a连接电源正极;b极为阴极,发生还原反应生成M,电极反应式为:![]() ,
,
故答案为:正;![]() ;
;
(2)c为阳极,电极反应式为:![]() ,产生碘单质,淀粉遇碘变蓝色,
,产生碘单质,淀粉遇碘变蓝色,
故答案为:C电极周围先变蓝色;![]() ;
;
(3)a电极为阳极,氢氧根放电生成氧气,电极反应式为:![]() ,d极产生氢气,d极上收集到44.8mL气体即0.002mol氢气时,电路中流过0.004mol电子,b极生成金属M的物质的量为0.004mol,故金属M的摩尔质量为
,d极产生氢气,d极上收集到44.8mL气体即0.002mol氢气时,电路中流过0.004mol电子,b极生成金属M的物质的量为0.004mol,故金属M的摩尔质量为![]() ,
,
故答案为:108g/mol;
(4)根据摩尔质量可以推知M为银,银离子和氯离子会产生氯化银沉淀,根据题中“取该溶液逐滴滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全”可推知,电解停止后稀释所得硝酸银的浓度0.1mol/L, 电解消耗了0.004mol银离子,溶液体积为0.2L,所以原溶液浓度为:![]() ,
,
故答案为:0.12mol/L。

【题目】一定温度下,在三个体积相同的恒容密闭容器中发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
C(s) | H2O(g) | CO(g) | H2(g) | CO(g) | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0 | 0.4 |
Ⅱ | 500 | 0 | 0 | 2.0 | 2.0 | |
Ⅲ | 400 | 1.0 | 1.0 | 0 | 0 | 0.3 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,容器内的压强:2PⅠ<PⅡ
C.达到平衡时,反应物的转化率αⅠ(H2O)+αⅡ(CO)<1
D.若起始时向容器Ⅰ中加入2.7 mol C(s)、0.4mol H2O(g)、0.6mol CO(g)和0.6mol H2(g),则反应将向逆反应方向进行
【题目】TiO2广泛应用于涂料、塑料、造纸、印刷油墨等领域。TiOSO4溶液加水稀释可析出aTiO2·bH2O沉淀。
(1)写出TiOSO4溶液加水稀释时所发生反应的化学方程式:____。
(2)实验室测定aTiO2·bH2O组成的方法如下:
步骤一:取样品4.900 g,在酸性条件下充分溶解,加入适量铝将溶解生成的TiO2+还原为Ti3+,将溶液转移到容量瓶中,并定容至250 mL。
步骤二:取25.00 mL定容后的溶液于锥形瓶中,加入KSCN溶液作指示剂,用0.2000mol·L-1的NH4Fe(SO4)2 标准溶液滴定,将实验数据记录在下表中。重复滴定2次。滴定过程发生的物质转化为:Ti3+![]() TiO2+
TiO2+
滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液 | |
滴定管起点读数/mL | 滴定管终点读数/mL | ||
1 | 25.00 | 0.04 | 25.04 |
2 | 25.00 | 0.07 | 25.05 |
3 | 25.00 | 0.13 | 25.15 |
①使用滴定管过程中所涉及下列操作的先后顺序是____(填字母)。
a.排除滴定管尖嘴处的气泡 b.检查滴定管是否漏液 c.用待装液润洗滴定管
②滴定终点的实验现象是____。
③通过计算确定该样品的组成,写出计算过程____。