题目内容
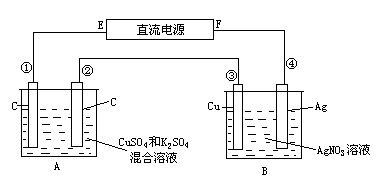
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度。
答案:
解析:
提示:
解析:
通电前A池中原混合溶液Cu2+的浓度为0.025mol/L。
|
提示:
第③极质量增加,说明第③极铜棒上析出金属银,此极为阴极,电源的E极为负极,F极为正极.在A池中,电解液为混合溶液,显然,在阴极Cu2+先放电,但要考虑到Cu2+完全放电后,H+放电的可能。A、B两池串联,在电解过程中,每个极上电子转移的总数目相等是解答本题的基本依据。 在A池中发生的反应为: 阳极(②极):4OH--4e=2H2O+O2↑ 阴极(①极):2Cu2++4e=2Cu 若Cu2+完全放电后还有:4H++4e=2H2↑ 转移电子的物质的量为: 由电极反应可知,每转移4mol电子,放出1molO2,所以②极上析出O2的体积为:
说明A池收集到的气体中还有H2。①极上放出H2为: ①极上析出Cu和放出H2共获得0.02mol电子。 Cu2+的物质的量为:
|

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目

 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL. 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度.
