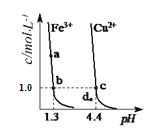
题目内容
【题目】下列说法正确的是( )
A. 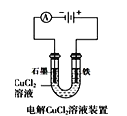 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 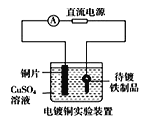 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 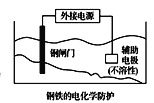 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
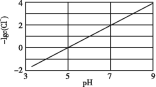
D. 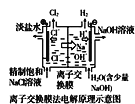 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
【答案】D
【解析】
A.在阳极Fe失去电子变为Fe2+进入溶液,Fe2+与KI不能发生反应,因此不能产生使湿润淀粉KI试纸变蓝的气体,A错误;
B.电镀时,应该把待镀铁制品与电源负极相连,作阴极,发生还原反应,B错误;
C.钢闸门应与外接电源的负极相连,称为外接电流的阴极保护法,C错误;
D.根据图示可知:该离子交换膜可以使Na+通过,而不能使Cl2通过,因此就可以避免生成的Cl2与NaOH溶液反应,D正确;
故合理选项是D。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。