题目内容
8.设NA代表阿伏加德罗常数,下列说法中,正确的是( )| A. | 标准状况下6.72L NH3的质量约为5.1g | |
| B. | 10g D216O分子中所含中子数为4NA | |
| C. | 2.3g金属钠全部变成钠离子失去的电子数目为0.2NA | |
| D. | 150mL1mol/L氯化钠溶液与50mL1mol/L AlCl3溶液中氯离子的物质的量浓度相等 |
分析 A、标况下,6.72L氨气的物质的量为0.3mol;
B、D216O的摩尔质量质量为20g/mol;
C、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
D、1mol/L的氯化钠溶液中氯离子浓度为1mol/L,而1mol/L的氯化铝溶液中氯离子的浓度为3mol/L.
解答 解:A、标况下,6.72L氨气的物质的量为0.3mol,故质量m=nM=0.3mol×17g/mol=5.1g,故A正确;
B、D216O的摩尔质量质量为20g/mol,故10gD216O的物质的量为0.5mol,而1molD216O中含10mol中子,故0.5molD216O中含5mol中子即5NA个,故B错误;
C、2.3g钠的物质的量为0.1mol,而反应后钠元素变为+1价,故0.1mol钠转移0.1mol电子即0.1NA个,故C错误;
D、1mol/L的氯化钠溶液中氯离子浓度为1mol/L,而1mol/L的氯化铝溶液中氯离子的浓度为3mol/L,故氯离子浓度之比为1:3,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
19.在某无色透明的溶液中,能大量共存的离子组是( )
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
3.18O是氧的一种同位素,下列说法正确的是( )
| A. | 18O原子所含中子数为8 | |
| B. | 1mol的1H218O分子所含质子数为12个 | |
| C. | 18O2气体的摩尔体积为22.4L/mol | |
| D. | 18O2气体的摩尔质量为36g/mol |
20.下列各组离子在溶液中能大量共存的是( )
| A. | K+、H+、Cl-、OH- | B. | K+、H+、HCO3-、Cl- | ||
| C. | Fe2+、H+、Br-、OH- | D. | K+、NH4+、SO42-、Cl- |
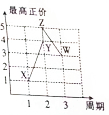 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 
 .
.