题目内容
已知2SO2(g)+O2(g)?2SO3(g)△H<0,对该反应的下列说法中正确的是( )
| A.O2的能量一定高于SO3的能量 |
| B.参加反应SO2和O2的总能量一定高于生成的SO3的总能量 |
| C.恒容条件下,升高温度,平衡时SO2浓度增大 |
| D.缩小容器的体积使压强增大,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
A、该反应正反应是放热反应,反应物的总能量高于生成物的总能量为放热反应,故SO2与O2的总能量一定高于SO3的能量,O2的能量不一定高于SO3的能量,故A错误;
B、该反应正反应是放热反应,反应物的总能量高于生成物的总能量为放热反应,故SO2与O2的总能量一定高于SO3的能量,故B正确;
C、该反应正反应是放热反应,恒容条件下,升高温度,平衡向逆反应移动,SO2浓度增大,故C正确;
D、缩小容器的体积使压强增大,反应混合物浓度都增大,正、逆反应速率都增大,该反应正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即向正反应移动,故D错误;
故选BC.
B、该反应正反应是放热反应,反应物的总能量高于生成物的总能量为放热反应,故SO2与O2的总能量一定高于SO3的能量,故B正确;
C、该反应正反应是放热反应,恒容条件下,升高温度,平衡向逆反应移动,SO2浓度增大,故C正确;
D、缩小容器的体积使压强增大,反应混合物浓度都增大,正、逆反应速率都增大,该反应正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即向正反应移动,故D错误;
故选BC.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知2SO2(g)+O2(g)═2SO3(g),△H=-197.8kJ?mol-1,则反应:SO3 (g)═
O2 (g)+SO2 (g)的△H是( )
| 1 |
| 2 |
| A、+197.8kJ?mol-1 |
| B、+98.9kJ?mol-1 |
| C、-296.7kJ?mol-1 |
| D、-98.9kJ?mol-1 |
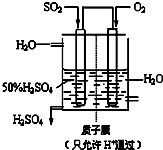
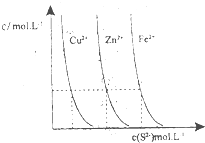 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: