题目内容
【题目】如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法不正确的是( )
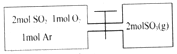
A. 第一次平衡时,SO2的物质的量左室更多
B. 入气体未反应前,左室压强和右室样大
C. 第一次平衡时,左室内压强一定小于右室
D. 第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
【答案】D
【解析】由于为恒容容器,1molAr对化学平衡无影响,容器中发生的反应为2SO2(g)+O2(g)![]() 2SO3(g)。A项,若右室的容积与左室相等,左室和右室在相同条件达到的平衡状态相同,含有的SO2物质的量相等,右室在此平衡时将体积缩小为1/2,增大压强,平衡向正反应方向移动,SO2物质的量减少,第一次平衡时,SO2物质的量左室更多,A项正确;B项,通入气体未反应前,左室气体总物质的量为2mol+1mol+1mol=4mol,右室气体总物质的量为2mol,左室容积为右室的两倍,温度相同,则左室压强和右室一样大,B项正确;C项,左室从正反应开始建立平衡,左室平衡时压强小于左室起始压强,右室从逆反应开始建立平衡,右室平衡时压强大于右室起始时压强,左室与右室起始压强相等,则第一次平衡时左室内压强一定小于右室,C项正确;D,若在容积为2倍左室容积的容器中起始充入4molSO2、2molO2,相同条件下达到平衡时SO2物质的量为左室SO2物质的量的2倍,打开活塞相当于容积为1.5倍左室容积的容器中起始充入2molSO2、1molO2、2molSO3(g)、1molAr,等效于容积为1.5倍左室容积的容器中起始充入4molSO2、2molO2、1molAr,相对于2倍左室容积的容器缩小体积,增大压强,平衡向正反应方向移动,SO2物质的量减小,即第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍要少,D项错误;答案选D。
2SO3(g)。A项,若右室的容积与左室相等,左室和右室在相同条件达到的平衡状态相同,含有的SO2物质的量相等,右室在此平衡时将体积缩小为1/2,增大压强,平衡向正反应方向移动,SO2物质的量减少,第一次平衡时,SO2物质的量左室更多,A项正确;B项,通入气体未反应前,左室气体总物质的量为2mol+1mol+1mol=4mol,右室气体总物质的量为2mol,左室容积为右室的两倍,温度相同,则左室压强和右室一样大,B项正确;C项,左室从正反应开始建立平衡,左室平衡时压强小于左室起始压强,右室从逆反应开始建立平衡,右室平衡时压强大于右室起始时压强,左室与右室起始压强相等,则第一次平衡时左室内压强一定小于右室,C项正确;D,若在容积为2倍左室容积的容器中起始充入4molSO2、2molO2,相同条件下达到平衡时SO2物质的量为左室SO2物质的量的2倍,打开活塞相当于容积为1.5倍左室容积的容器中起始充入2molSO2、1molO2、2molSO3(g)、1molAr,等效于容积为1.5倍左室容积的容器中起始充入4molSO2、2molO2、1molAr,相对于2倍左室容积的容器缩小体积,增大压强,平衡向正反应方向移动,SO2物质的量减小,即第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍要少,D项错误;答案选D。

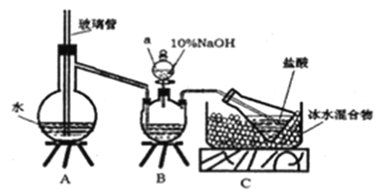
【题目】用下列装置制备二氧化氮气体,并探究相关产物性质。
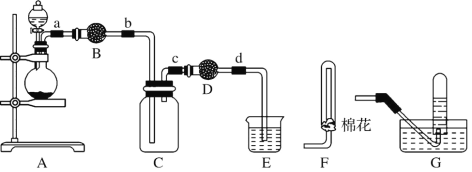
(1) 装置A中的分液漏斗盛装的液体是____,烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜不用铁的原因是______________。
(2) 干燥管B、D中盛装的干燥剂可以是____(填“浓硫酸”、“无水氯化钙”、“五氧化二磷”或“碱石灰”),干燥管D中干燥剂的作用是______________。
(3) 装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下,请将其补充完整。
NaOH+ NO2![]() + NaNO2+ H2O ______
+ NaNO2+ H2O ______
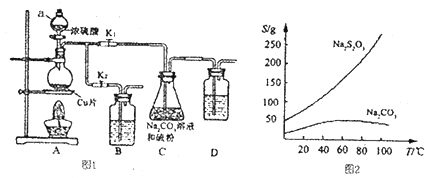
(4) 某化学兴趣小组认为铜和适量浓硝酸反应产生的气体中含NO,选用下列必要的装置(N2和O2的用量可自由控制)完成验证实验。
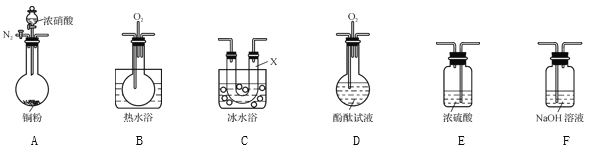
已知:
i. NO+NO2+2OH-![]() 2NO2-+H2O
2NO2-+H2O
ii气体液化温度如下:
气体 | NO2 | NO |
液化温度 | 21 ℃ | -152 ℃ |
①仪器的连接顺序(按从左→右连接,填各仪器字母)为________。
②实验时先检查装置气密性后,再加入试剂,在反应前的操作是_______。
③确认气体中含NO的现象是__________;装置C的作用是____。
④NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的气体中氮氧化物脱除技术。现在有NO、NO2的混合气6 L,可用同温同压下7 L NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为____。