题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是
- A.37Cl-所含有的电子数为18NA
- B.实验室用MnO2与浓盐酸制取11.2L氯气,转移电子数为NA
- C.标准状况下,22.4L35Cl2气体所含中子数为36NA
- D.18gD2O与18gH2O含有电子数都为10NA
C
分析:A、阴离子中电子数=质子数+电荷数;
B、根据气体摩尔体积的使用条件判断;
C、根据N=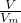 NA结合一个氯气分子中含有的中子数计算;
NA结合一个氯气分子中含有的中子数计算;
D、根据N= NA结合一个分子中含有的电子数计算.
NA结合一个分子中含有的电子数计算.
解答:A、37Cl-所含有的电子数为18,故A错误;
B、因为气体体积与温度、压强有关,所以有关气体体积的计算必须知道温度和压强,该题中温度和压强未知,所以无法计算,故B错误;
C、氯气的分子数N=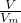 NA=
NA=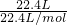 NA=NA,一个35Cl2分子中含有36个中子,所以标准状况下,22.4L35Cl2气体所含中子数为36NA,故C正确;
NA=NA,一个35Cl2分子中含有36个中子,所以标准状况下,22.4L35Cl2气体所含中子数为36NA,故C正确;
D、一个D2O与H2O中含有电子数都为10个,18gD2O的物质的量为 =0.9mol,18gH2O的物质的量为
=0.9mol,18gH2O的物质的量为 ,所以含有的电子数不同,故D错误;
,所以含有的电子数不同,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是B,有关气体体积的计算要注意温度和压强是否是标况下,才能决定是否可用气体摩尔体积22.4L/mol.
分析:A、阴离子中电子数=质子数+电荷数;
B、根据气体摩尔体积的使用条件判断;
C、根据N=
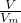 NA结合一个氯气分子中含有的中子数计算;
NA结合一个氯气分子中含有的中子数计算;D、根据N=
 NA结合一个分子中含有的电子数计算.
NA结合一个分子中含有的电子数计算.解答:A、37Cl-所含有的电子数为18,故A错误;
B、因为气体体积与温度、压强有关,所以有关气体体积的计算必须知道温度和压强,该题中温度和压强未知,所以无法计算,故B错误;
C、氯气的分子数N=
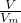 NA=
NA=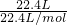 NA=NA,一个35Cl2分子中含有36个中子,所以标准状况下,22.4L35Cl2气体所含中子数为36NA,故C正确;
NA=NA,一个35Cl2分子中含有36个中子,所以标准状况下,22.4L35Cl2气体所含中子数为36NA,故C正确;D、一个D2O与H2O中含有电子数都为10个,18gD2O的物质的量为
 =0.9mol,18gH2O的物质的量为
=0.9mol,18gH2O的物质的量为 ,所以含有的电子数不同,故D错误;
,所以含有的电子数不同,故D错误;故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是B,有关气体体积的计算要注意温度和压强是否是标况下,才能决定是否可用气体摩尔体积22.4L/mol.

练习册系列答案
相关题目