题目内容
5.下列溶液或浊液中,说法正确的是( )| A. | 一定浓度的氨水加水稀释的过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大 | |
| B. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1 和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O=Na2CO3+2HClO | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| D. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) |
分析 A、一水合氨是弱电解质,存在电离平衡,加水稀释,平衡正向移动;
B、弱酸的电离平衡常数越大,弱酸酸性越强,HClO的酸性比HCO3-强;
C、pH相同说明氢离子浓度与氢氧根离子浓度相同,据电荷守恒分析;
D、据电荷守恒分析.
解答 解:A、加水稀释,平衡正向移动n(NH4+)增大,n(NH3•H2O)减小,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大,故A正确;
B、HClO的酸性比HCO3-强,所以NaClO+CO2(少量)+H2O=NaHCO3+HClO,故B错误;
C、据电荷守恒c(NH4+)+c(H+)=c(OH-),c(K+)+c(H+)=c(OH-),2c(Ba2+)+c(H+)=c(OH-),pH相同则c(OH-)、c(H+)都相同,所以c(NH4+)=c(K+)=2c(Ba2+),故C错误;
D、据电荷守恒,c(OH-)+c(CH3COO-)=c(Na+)+c(H+),溶液显中性,所以c(CH3COO-)=c(Na+),故D错误;
故选A.
点评 本题考查了弱电解质加水稀释时离子浓度变化、强酸制弱酸原理、离子浓度大小比较,题目难度不大,注意电荷守恒的应用.

练习册系列答案
相关题目
11.NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或二种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取二份等体积混合液,用盐酸的标准液(0.10mol/L)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1,则NaCl溶液中混有的杂质不可能为( )
| A. | NaOH | B. | Na2CO3 | C. | Na2CO3、NaHCO3 | D. | NaOH、Na2CO3 |
16.图中I是氢氧燃料电池的示意图,某同学想在II中实现Fe上镀铜,下列说法正确的是( )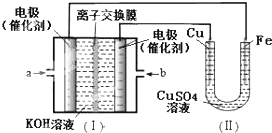

| A. | a处通入O2 | B. | b处发生氧化反应 | ||
| C. | 电流由Cu电极移向b | D. | Fe电极发生的反应为:Cu2++2e-=Cu |
13.化学与人类生产、生活密切相关,下列有关说法不正确的是( )
| A. | 血糖过低的患者可利用静脉注射葡萄糖溶液的方法迅速补充营养 | |
| B. | 装运乙醇的包装箱应贴的图标是 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
20.下列说法不正确的是( )
| A. | 纯碱溶液清洗油污,加热可增强其去污能力 | |
| B. | 门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料 | |
| C. | 聚丙烯酸钠是一种高吸水性树脂 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
10.下列说法不正确的是( )
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒不同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
17.下表中对应关系正确的是( )
| A | 甲基橙溶液呈黄色的溶液,一定能大量存在的离子 | Na+、Fe3+、Cl-、SO42- |
| B | 在久置的氯水中能大量共存的微粒 | K+、Al3+、NO3-、HCOOH |
| C | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全: | 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D | 1L0.1mol/LCuSO4溶液和足量的Ca充分反应 | 最终生成6.4gCu |
| A. | A | B. | B | C. | C | D. | D |
14.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
(1)R的原子结构示意图是 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| Q | R | ||
| T | W |
 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
15.下列说法中正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2和O3互为同位素 | |
| C. | CH3-CH2-CH2-CH3与 互为同系物 互为同系物 | |
| D. |  与 与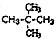 互为同分异构体 互为同分异构体 |