题目内容
(8分)请回答下列各问:
(1)酸雨的pH范围是 ,在空气质量报告的各项指标中有可吸入颗粒物,还有 。
(2)石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂在吸收塔中与废气中的SO2反应而将硫固定,写出反应的化学方程式 。
(3)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu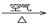 CuO
CuO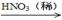 Cu(NO3)2
Cu(NO3)2
(4)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
(1)酸雨的pH范围是 ,在空气质量报告的各项指标中有可吸入颗粒物,还有 。
(2)石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂在吸收塔中与废气中的SO2反应而将硫固定,写出反应的化学方程式 。
(3)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu
 CuO
CuO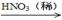 Cu(NO3)2
Cu(NO3)2 (4)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
(共8分)
(1)pH﹤7 (1分) SO2 NO2(1分)
(2)Ca CO3 CaO + CO2↑(1分),Ca SO3 CaO + SO2(1分)
(3)③(1分)
(4)D (2分)
(5)Cu+2HCl+H2O2==CuCl2+2H2O(1分)
(1)pH﹤7 (1分) SO2 NO2(1分)
(2)Ca CO3 CaO + CO2↑(1分),Ca SO3 CaO + SO2(1分)
(3)③(1分)
(4)D (2分)
(5)Cu+2HCl+H2O2==CuCl2+2H2O(1分)
略

练习册系列答案
相关题目

 应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: 质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。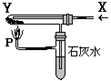
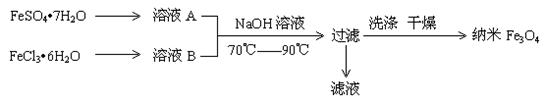
 O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。
O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。
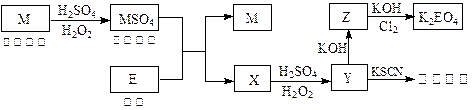
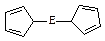 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。