题目内容
【题目】目前汽车尾气中的NO处理有以下几种方法:
(1)在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H 。
N2(g)+2CO2(g) △H 。
①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1
则△H=______。
②一个兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化如图1所示,前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是_____________________。同时该小组在固定容积为2L的密闭容器中通入NO和CO各2mol进行反应,n(CO2)随温度(T)、压强(P)和时间(t)的变化曲线如图2所示,图中的曲线Ⅰ、Ⅱ、Ⅲ对应反应从开始到平衡时用CO2表示的平均反应速率分别为v(Ⅰ)、v(Ⅱ)、v(Ⅲ),则三者大小关系为______________。

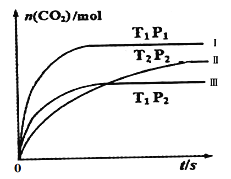
图1 图2
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.250 | 4.56 |
根据上表数据,写出容器中发生反应的化学方程式____,并判断X_____200℃(用“>”、“<“或“=”填空),计算反应体系在200℃时的平衡常数Kp =_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
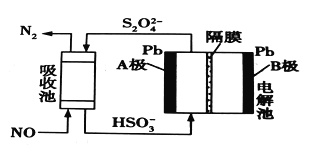
(3)用间接电化学法除去NO的过程,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,B极为_________(填“阳极”或“阴极”);写出A极的电极反应式:____________。
【答案】 -746.5kJ·mol-1 尚未达到催化剂工作温度(或尚未达到反应的温度) v(Ⅰ)>v(Ⅲ)>v(Ⅱ) C+2NO![]() N2+CO2 > 0.5625 阳极 2HSO3-+2e-+2H+==S2O42-+2H2O
N2+CO2 > 0.5625 阳极 2HSO3-+2e-+2H+==S2O42-+2H2O
【解析】分析:(1)①根据盖斯定律解答;②根据曲线的拐点时间来确定化学反应速率的大小;
(2)根据温度对化学平衡的影响知识来回答判断,根据三段式来进行计算,据化学平衡移动的影响因素来确定转化率的变化;(3)由HSO3-到S2O42-,硫元素的化合价降低分析。
详解:(1)① 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H,
N2(g)+2CO2(g) △H,
①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
② C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,
则根据盖斯定律可知②×2-①-③即得到反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的反应热△H=2△H2-△H1-△H3=(-393.5kJ·mol-1)×2-180.5kJ·mol-1
N2(g)+2CO2(g)的反应热△H=2△H2-△H1-△H3=(-393.5kJ·mol-1)×2-180.5kJ·mol-1
-(-221kJ·mol-1)=-746.5kJ·mol-1 。
②从图1看出CO、NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度)。
根据图象中,达平衡用到的时间,可以知道反应速率是:υ(Ⅰ)>υ(Ⅲ)>υ(Ⅱ),故答案为:υ(Ⅰ)>υ(Ⅲ)>υ(Ⅱ);
(2)由题设信息及表中数据可知C、NO、A、B反应的化学计量比为0.03:0.06:0.03:0.03=1:2:1:1,且C被氧化,结合原子守恒可推出生成物为N2和CO2,则反应方程式为: C+2NO![]() N2+CO2;
N2+CO2;
反应前后气体的物质的量不变,温度升高压强增大;
Kp=![]() =
=![]() =0.5625,
=0.5625,
故答案为:C+2NO![]() N2+CO2;>;0.5625;
N2+CO2;>;0.5625;
(3)由HSO3-到S2O42-,硫元素的化合价降低,可知该电极反应得电子,在电解池的阴极附近发生,B极为阳极,A极为阴极,电解池的阴极室中溶液的pH在4~7之间,为酸性环境,因此阴极附近电极反应式为2 HSO3-+2e-+2H+= S2O42-+2H2O ;因此,本题答案为:阳极 ;2HSO3-+2e-+2H+==S2O42-+2H2O。

 口算能手系列答案
口算能手系列答案【题目】TiC14是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):
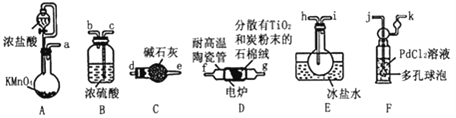
已知:
①PdC12溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiC14的制备需无水无氧且加热。
③
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 水溶性 |
TiCl4 | -25 | 136.4 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水,与TiCl4互溶 |
请回答下列问题:
(1)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为a→____→____→f→g→___→____→_____→_____→_____(填仪器接口字母)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_____________(按正确的顺序填入下列操作的序号)。
①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到____________________________时,开始进行步骤①。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:___________。
(5)装置F中发生反应的化学方程式为____________________。
(6)制得的TiC14产品中常含有少量CC14,从产品中分离出TiC14的操作名称为_____________________________。