��Ŀ����
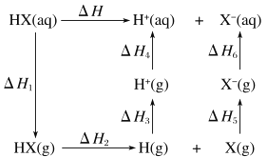
����Ŀ������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ(ͼ�е���H��ʾ����1mol���������)��

����ͼ�ش��������⣺
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ��__��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ��__��
��3��P��Cl2��������Ӧ����1molPCl5����H3=_��P��Cl2һ����Ӧ����1molPCl5����H4__��H3(������������С��������������)��
���𰸡�P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol�� 399kJ/mol ����
��������
���ݸ�˹���ɣ���Ӧ����;���أ�ֻ����ʼ���ʡ����������йأ��Դ˽���⡣
(1)�������������ȥ��Ӧ����������͵�����H�����ͼ���֪��PCl3�ͷ�Ӧ��P��Cl2��������Ϊ306kJ����˸��Ȼ�ѧ����ʽΪ��P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol���ʴ𰸣�P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol��
(2)����ͼ���֪PCl5��PCl3��Cl2֮���������Ϊ-93kJ�����PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽΪ��PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol���ʴ𰸣�PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol��
(3)���ݸ�˹���ɣ���H=-306kJ/mol-93kJ/mol=-399kJ/mol���÷�Ӧ����;���أ�ֻ����ʼ���ʡ����������йأ�����P��Cl2һ����Ӧ����1molPCl5����H4������H3���ʴ𰸣�399kJ/mol�����ڡ�

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)��H2(g) ![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
t �� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��_________________________________��
��2���÷�ӦΪ________��Ӧ(��������������������)��
��3��ij�¶��£������ʵ�ƽ��Ũ�ȷ�����ʽ��3c(CO2)��c(H2)��5c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ______��
��4����830 ��ʱ���������г���1 mol CO��5 mol H2O����Ӧ�ﵽƽ����仯ѧƽ�ⳣ��K______1.0(������������С��������������)��
��5��830 ��ʱ�������еķ�Ӧ�Ѵﵽƽ�⡣�������������������£����������������ƽ��____�ƶ�(����������Ӧ�����������淴Ӧ��������������)��
��6����1 200 ��ʱ����ijʱ��ƽ����ϵ��CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2 mol��L��1��2 mol��L��1��4 mol��L��1��4 mol��L��1�����ʱ������Ӧ��ƽ���ƶ�����Ϊ__________(��������Ӧ���������淴Ӧ�������������ƶ���)��