题目内容
7.铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:2Fe3++Cu═2Fe2++Cu2+
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图.
分析 (1)氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液.
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: .
.
点评 本题考查了原电池设计,知道哪些反应能设计成原电池,根据反应中元素化合价变化确定正负极、电解质溶液,原电池设计是学习难点,也是考试热点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: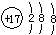 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | Na+的电子式:Na+ |
18.下列操作能导致置换反应发生的是( )
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
15.化学反应的发生必然伴随有能量的转化,其最根本的原因是( )
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
2.下列关于化学反应限度的叙述错误的是( )
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
12.有两种主族元素X和Y,X元素的单质通常是黄色固体,X原子M电子层上的电子数为Y原子M电子层上的电子数的3倍,则X、Y的元素符号分别为( )
| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
19.主族元素X的阳离子和主族元素Y的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子半径比Y的大 | B. | X原子的最外层电子数比Y的大 | ||
| C. | X的原子序数比Y的小 | D. | X元素的最高正价比Y的大 |
16.下列有关物质用途或现象以及反应方程式不正确的是( )
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
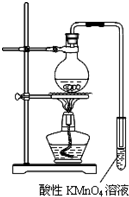 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O