题目内容
(6分)写出下列各粒子的化学式
(1)由2个原子组成的具有10个电子的分子 阴离子是
(2)由4个原子组成的具有10个电子的分子是 阳离子是
(3)由3个原子组成的具有18个电子分子是
(4)由5个原子组成的具有10个电子的阳离子是 。
HF OH — NH3 H3O+ H2S NH4+
【解析】考查常见的10电子或18电子微粒。首先确定10电子和18电子的中性原子Ne和Ar,然后找出比它们多或少电子的原子转化成阴、阳离子或氢化物分子。
(1)具有10电子的原子是Ne原子.
(2)其它10电子微粒一般是Ne原子前后的元素通过得失或共用电子对来达到10个电子的.如:
①.Ne原子前面元素的氢化物.有CH4、NH3、H2O、HF.
②.上述氢化物去氢以后形成的阴离子,如:NH2-、N3-、O2-、F-等.
③.上述氢化物加H+后形成的阳离子.如:NH3+H+=NH4+ , H2O+H+=H3O+
④.Ne原子后金属元素的阳离子.如:Na+、Mg2+、Al3+等.
2、基团 -F、-OH、-NH2、-CH3(均含9个电子),两个自身合并或两两之间交换组合均可得到含18电子的微粒。

 快乐暑假暑假能力自测中西书局系列答案
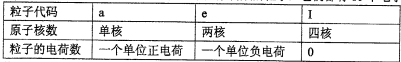
快乐暑假暑假能力自测中西书局系列答案已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
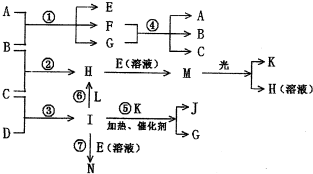
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:?
(1)写出下列物质的化学式:B J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。?②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。