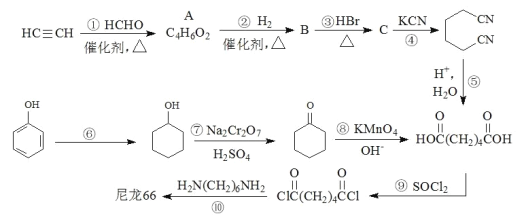
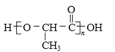
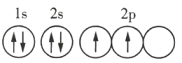
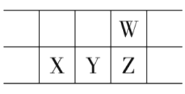
题目内容
【题目】25℃时,下列关于 pH=3 的 CH3COOH 溶液的叙述正确的是
A.溶液中 H2O 电离出的 c(OH)=1.0×103 mol·L1
B.加0.1 mol·L1CH3COONa 溶液使 pH>7,则 c(CH3COO)=c(Na+)
C.加入少量 CH3COONa 固体后,溶液 pH 升高
D.与等体积 pH=11 的 NaOH 溶液混合,所得溶液呈中性
【答案】C
【解析】
A.pH=3的CH3COOH溶液中氢离子的浓度为103 mol·L1,是由醋酸电离产生的,而溶液中的氢氧根由水电离提供,由Kw= c(H+)×c(OH-)可求得c(OH-)= ,故A错误;
,故A错误;
B.加入醋酸钠后溶液中有电荷守恒c(CH3COO)+ c(OH-)=c(Na+)+ c(H+),因为溶液的pH>7, 即c(OH-)>c(H+),所以c(CH3COO)<c(Na+),故B错误;
C.因为错酸钠显碱性,所以加入醋酸钠后,溶液的碱性会增强,溶液pH会升高,故C正确;
D.pH=3的CH3COOH溶液电离出的氢离子与等体积pH=11的NaOH溶液电离产生的氢氧根物质的量相等,但发生酸碱中和时,溶液中的醋酸分子还能继续电离产生氢离子,最终使溶液显酸性,故D错误;
综上所述,答案为C。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目