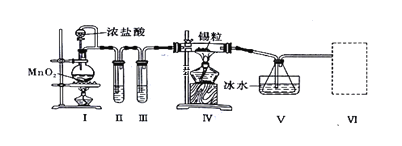
题目内容
【题目】(1)能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

该条件下反应的平衡常数为_____;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO的浓度为____mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【答案】BC 2.0 1.33 A
【解析】
(1)紧扣化学平衡的特征进行判断,一是正、逆反应速率相等,一是变量不变;
(2)①先利用平衡常数的本义式求算出平衡常数,再利用三段式和平衡常数进行计算;
②在化学方程式确定后,平衡常数只是温度的函数;
(1)A.该反应是一个气体分子总数前后不变的反应,所以在恒温恒容条件下,压强始终不变,A项排除;
B.浓度不变是化学平衡建立的一个重要特征,B项可选;
C.v正(H2)代表氢气的消耗速率,v逆(H2O)代表了水的消耗速率(从反应式可以看出,与氢气的生成速率相等),所以此等式的成立代表了氢气的生成速率与消耗速率相等,反应达平衡,C项可选;
D.平衡时是浓度不变,不是相等,也不是成比例,所以D项排除;
所以答案选择BC项。
(2)①据图分析平衡时二氧化碳的浓度分别为0.5mol/L,二氧化碳的浓度变化为:1.5mol/L-0.5mol/L=1mol/L,根据反应方程式可以知道反应生成CO的浓度为1mol/L,则该反应的平衡常数K=![]() =
=![]() =2.0;
=2.0;
若CO2起始时的浓度为2.0mol/L,据反应方程式可以知道,反应消耗的二氧化碳的浓度与生成CO的浓度相等,设二者的浓度为xmol/L,则平衡时二氧化碳的浓度为(2.0-x)mol/L,
K=![]() =2.0,解得x=
=2.0,解得x=![]() ,所以平衡时CO的浓度为1.33mol/L、二氧化碳的浓度为(2.0-
,所以平衡时CO的浓度为1.33mol/L、二氧化碳的浓度为(2.0- ![]() )mol/L= x=
)mol/L= x=![]() mol/L;
mol/L;
②所给比例式即为该反应的平衡常数,而平衡常数只随温度变化而变化,不随浓度、压强等变化。该反应是正向吸热的反应,温度升高,平衡常数将增大。
A.升高温度,平衡正向进行,平衡常数增大,A项正确;
B.增大压强,平衡不动,平衡常数也不变,B项错误;
C.充入一定量的二氧化碳,平衡正向移动,但因为温度不变,平衡常数不变,C项错误;
D.铁粉为固体,再加入铁粉,平衡不发生移动,该反应的平衡常数不变,D项错误;
所以答案选择A项。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】苯甲酸(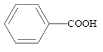 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(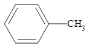 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
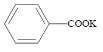 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
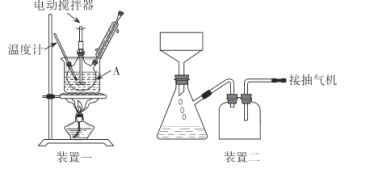
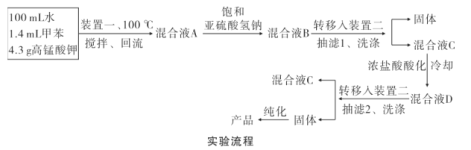
实验装置(部分夹持装置已略去)和流程如下:
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。