题目内容
下列各溶液中,各粒子的物质的量浓度关系正确的是( )
| A、0.1mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、0.1mol/L NaHCO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) |
| D、0.1mol/L Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.任何电解质中都存在电荷守恒,根据电荷守恒判断;
B.硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,铵根离子水解程度较小;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断;
D.溶液中存在物料守恒,根据物料守恒判断.
B.硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,铵根离子水解程度较小;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断;
D.溶液中存在物料守恒,根据物料守恒判断.
解答:
解:A.任何电解质中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A错误;
B.硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒2c(SO42-)+c(OH-)=c(NH4+)+c(H+),铵根离子水解程度减小,所以c(SO42-)<c(NH4+),故B错误;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),根据物料守恒c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),所以得c(H2CO3)+c(H+)=c(CO32-)+c(OH-),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故D正确;
故选D.
B.硫酸铵是强酸弱碱盐,铵根离子水解而使溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒2c(SO42-)+c(OH-)=c(NH4+)+c(H+),铵根离子水解程度减小,所以c(SO42-)<c(NH4+),故B错误;
C.溶液中存在电荷守恒、物料守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),根据物料守恒c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),所以得c(H2CO3)+c(H+)=c(CO32-)+c(OH-),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液碱性再结合物料守恒、电荷守恒来分析解答即可,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A、反应的化学方程式为4X?Y |
| B、当t1=2时,用X表示该反应在2min内的平均反应速率为0.25mol/(L?min) |
| C、t2时,正反应速率等于逆反应速率 |
| D、t3时,Y浓度不再变化,反应达到平衡 |
能大量共存于同一溶液中,且当改变条件使水电离的c(H+)=10-13mol/L时,一定能发生反应的离子组是( )
| A、S2-、Na+、SO32-、Cl- |
| B、Ca2+、NH4+、SO42-、SiO32- |
| C、Na+、Ba2+、Cl-、HSO3- |
| D、Al3+、Na+、SO42-、NO3- |
某强碱性溶液中一定能大量共存的离子组是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、K+、Na+、NO3-、HCO3- |
| C、Na+、Fe2+、NO3-、SCN- |
| D、Na+、Ca2+、SiO32-、Cl- |
下列方法中,不能用于实验室里制取氨的是( )
| A、在烧瓶中将熟石灰和氯化铵混合,加水调成泥糊状后加热 |
| B、将分液漏斗中的浓氨水滴入装有浓硫酸的烧瓶中 |
| C、加热试管中的铵盐和碱的混合物 |
| D、加热试管中的氯化铵固体 |
下列分子中,既含有σ键又含有π键的是( )
| A、CH4 |
| B、HCl |
| C、CH2═CH2 |
| D、F2 |

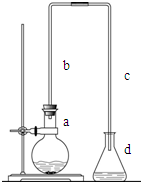 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.