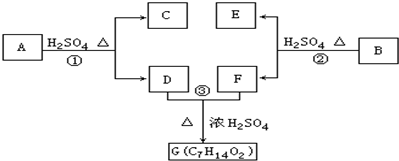
题目内容
15.科学家在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键)所示,下列说法正确的是( )
| A. | X与溴水混合,液体分层,上层橙红色 | |
| B. | X是一种在常温下能稳定存在的液态烃 | |
| C. | X分子中在同一平面上的碳原子最多3个 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气多 |
分析 由结构简式可知,X为C5H4,分子中含2个C=C键,能够与溴水发生加成反应,含氢量小于甲烷,等质量的X和甲烷分别充分燃烧,甲烷消耗的氧气多,再结合烯烃的性质来解答.
解答 解:由结构简式可知,X为C5H4,分子中含2个C=C键,
A.含有碳碳双键,可与溴水发生加成反应,溴水褪色,故A错误;
B.在-100℃的低温下合成一种烃X,则常温下不能稳定存在,故B错误;
C.分子中5个碳原子形成的构型为正四面体,5个原子不共面,在同一平面上的碳原子最多3个,故C正确;
D.甲烷含氢量较大,燃烧等质量的X和甲烷,甲烷耗氧量较大,故D错误.
故选C.
点评 本题考查了有机物的结构与性质,题目难度中等,注意掌握有机物结构与性质,明确图中结构简式与烃中含C=C键是解题关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
6. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
20.下列变化一定属于化学变化的是( )
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
| A. | ①②③④⑦ | B. | ③④⑤⑦⑨ | C. | ①③⑤⑦⑨ | D. | ①③④⑦⑩ |
7.为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
②写出实验操作“步骤一”中的反应离子方程式:4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓.
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
4.在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
 ;
;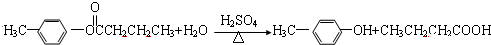 ;
; ;
; .
. 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).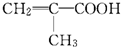 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$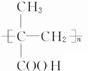 .
.