题目内容
等体积的NaCl,MgCl2,MgCl2,AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3恰好完全反应,则所需NaCl,MgCl2,AlCl3三种溶液的物质的量浓度之比是
[ ]
解析:
|
三种溶液分别与AgNO3溶液作用的离子方程式只有一个,即Cl-+Ag+=AgCl↓.因为AgNO3是等体积等物质的量浓度,所以三种溶液消耗掉的AgNO3的物质的量是相等的.由上述离子方程式知,则三种氯化物溶液中的Cl-的物质的量也是相等的.再由三种氯化物的组成,知三种氯化物溶液中NaCl,MgCl2,AlCl3的物质的量之比一定为1∶ |
提示:
|
虽说是三种氯化物的溶液和AgNO3溶液作用有三个化学方程式,实质只有一个反应,然后由消耗的Ag+的物质的量相等,推出结论为三种溶液中的Cl-的物质的量也相等,然后推理下去得结论. |

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案(14分)根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa ⑥CH3COOH ⑦ NH3?H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加Na2CO3固体 |
| C.加热至100℃[其中c(H+) = 1×10-6 mol?L-1] | D.向水中加入 (NH4)2SO4固体 |
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________________________________________。
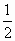 ∶
∶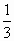 .又因三种氯化物溶液的体积相同,所以三种溶液的物质的量浓度之比也就是溶质的物质的量之比了.
.又因三种氯化物溶液的体积相同,所以三种溶液的物质的量浓度之比也就是溶质的物质的量之比了. H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
。