题目内容
5.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )| A. | 放电时正极反应式为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性增强 |
分析 A.放电时,正极上发生得电子的还原反应,根据总反应来书写电极反应;
B.充电时,阳极上铁离子失去电子,发生Fe(OH)3转化为FeO42-的反应;
C.根据Zn元素失去电子,正极Fe元素得到电子来分析;
D.充电时根据氢氧根离子浓度变化确定溶液酸碱性变化.
解答 解:A.放电时,正极上发生得电子的还原反应,FeO42-+4H2O+3e-=Fe(OH)3+5OH-,故A错误;
B.充电时,铁离子失去电子,发生Fe(OH)3转化为FeO42-的反应,电极反应为Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B错误;
C.放电时Zn元素失去电子,正极Fe元素得到电子,转移电子数为1mol×(6-3)=3mol,放电时每转移3 mol电子,正极有1 mol K2FeO4被还原,故C错误;
D.放电时正极附近发生得电子的还原反应,FeO42-+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,所以碱性增强,故D正确;
故选D.
点评 本题考查电解池与原电池,明确电极反应中放电为原电池、充电为电解池时解答本题的关键,题目难度不大

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
16.下列物质的命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基-2-乙基乙烷 | ||
| C. | 2,3-二甲基-4-乙基己烷 | D. | 2,5,5-三甲基己烷 |
13.下列离子方程式书写正确的是( )
| A. | 硫酸铁中加入少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 将铝投入CuSO4溶液中:Al+Cu2+═Cu+Al3+ |
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | Fe(OH)3胶体、白磷、石灰乳 | B. | 干冰、铁、氯化氢 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、明矾 |
10.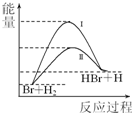 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
 相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如右图所示.则下列叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 反应热:过程I>过程II | |
| C. | 过程Ⅱ的平衡常数>过程I的平衡常数 | |
| D. | 形成1 mol 化学键释放的能量:H-Br<H-H |
17.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:
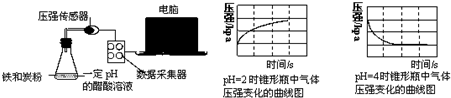
分析图象,以下结论错误的是( )

分析图象,以下结论错误的是( )
| A. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| B. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| C. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
14.油脂水解的最终产物是( )
| A. | 酸和甘油 | B. | 水 | C. | CO2 | D. | 水和CO2 |
15.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离,不存在电离平衡 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |