题目内容
 已知H2B在水溶液中存在以下电离:
已知H2B在水溶液中存在以下电离:一级电离:H2B
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2-请回答以下问题:
(1)NaHB溶液
 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性(2)若0.1mol?L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol?L-1,则H2B的一级电离的电离度为
(3)某温度下,在0.1mol?L-1的NaHB溶液中,以下关系一定不正确的是
A.c(H+)?c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol?L-1≥c(B2-)
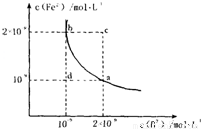
(4)某温度下,FeB(s)
 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.
(2)H2B溶液存在两步电离,以第一步电离为主,电离度=
| 电离掉的弱酸的量 |
| 原来的总量 |
(3)根据盐的水解、溶液中的离子积表达式和数值、质子守恒知识来解决;
(4)沉淀溶解平衡曲线上的点是平衡状态的点,根据沉淀溶解平衡知识来解决.
故答案为:无法确定;NaHB溶液中同时存在HB?
 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性;
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性;(2)H2B溶液的一级电离为:H2B
 H++HB-,二级电离为:HB-
H++HB-,二级电离为:HB- H++B2-,c(B2-)=1×10-6mol?L-1,所以二级电离出的氢离子浓度为1×10-6mol?L-1,所以一级电离生成的氢离子浓度为1×10-3mol?L-1-1×10-6mol?L-1≈1×10-3mol?L-1,所以电离度=
H++B2-,c(B2-)=1×10-6mol?L-1,所以二级电离出的氢离子浓度为1×10-6mol?L-1,所以一级电离生成的氢离子浓度为1×10-3mol?L-1-1×10-6mol?L-1≈1×10-3mol?L-1,所以电离度=| 1×10-3mol/L |
| 0.1mol/L |
(3)A、常温下,任何溶液中离子积表达式Kw=c(H+)?c(OH-)=1×10-14均成立,故A正确;
B、NaHB溶液中弱离子不能完全电离,所以0.1mol?L-1的NaHB溶液中氢离子浓度小于0.1mol/L,pH>1,故B正确;
C、根据0.1mol?L-1的NaHB溶液中的质子守恒c(OH-)=c(H2B)-c(B2-)+c(H+),故C错误;
D、c(Na+)=0.1mol?L-1,B2-离子是弱离子水解出来的,一定比钠离子浓度小,故D错误.
故选CD;
(4)A、a、b两点均是平衡状态的点,所以a点对应的KSP等于b点对应的KSP,故A正确;
B、d点的Qc小于KSP,所以无沉淀生成,故B正确;
C、c点Qc大于KSP,升温,沉淀溶解平衡向右移动导致Qc更大,不会到a点,故C错误;
D、取平衡态下的任何一点a点,此温度下,KSP=2×10-9×10-9=2×10-18,故D错误.
故选CD.

已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
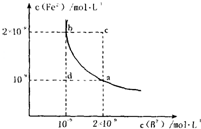
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18


 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______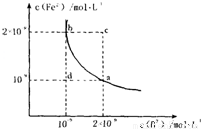
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______