题目内容
5.孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图:(1)研磨孔雀石的目的是加快反应速率.
浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是SiO2 (填化学式).
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用B (填序号):
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O.
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离.则试剂C宜选用D(填序号):
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
固体c的化学式为Fe(OH)3.
(4)1mol氨气通过加热的Cu2(OH)2CO3可以产生1.5mol金属铜,氨气被还原产生N2,则该反应的化学方程式为4NH3+3Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6Cu+3CO2+9H2O.
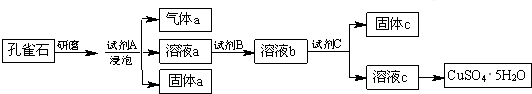
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体a、溶液a和固体a,因为最终得到硫酸铜,且能得到气体,试剂A为稀硫酸,碱式碳酸铜、铁的氧化物都能和稀硫酸反应生成硫酸盐,二氧化硅和稀硫酸不反应,所以a为CO2、溶液中溶质为硫酸铜、铁的硫酸盐,固体a为SiO2;试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B应该具有强氧化性,能氧化亚铁离子但不能引进新的杂质,所以B为双氧水;
试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体c和溶液c,将溶液c加热浓缩、冷却结晶、过滤得到五水硫酸铜,据此分析解答.
解答 解:孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体a、溶液a和固体a,因为最终得到硫酸铜,且能得到气体,试剂A为稀硫酸,碱式碳酸铜、铁的氧化物都能和稀硫酸反应生成硫酸盐,二氧化硅和稀硫酸不反应,所以a为CO2、溶液中溶质为硫酸铜、铁的硫酸盐,固体a为SiO2;试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B应该具有强氧化性,能氧化亚铁离子但不能引进新的杂质,所以B为双氧水;
试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体c和溶液c,将溶液c加热浓缩、冷却结晶、过滤得到五水硫酸铜,
(1)反应物的接触面积越大,反应速率越快,所以研磨孔雀石的目的是加快反应速率;
浸泡孔雀石的试剂A若选用过量的稀硫酸,只有二氧化硅不和稀硫酸反应,则固体a是,
故答案为:加快反应速率;SiO2;
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,B应该具有强氧化性且不能引进新的杂质,
酸性高锰酸钾、浓硝酸和氯水都具有强氧化性,能将亚铁离子氧化为铁离子同时产生杂质,双氧水不能产生杂质,故选B;
相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:B;2Fe2++2H++H2O2=2Fe3++2H2O;
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,C能和稀硫酸反应导致溶液pH升高,铁离子转化为氢氧化铁沉淀,但不能引进杂质,
A.加入稀硫酸溶液pH降低,铁离子不能转化为沉淀,故错误;
B.加入NaOH溶液,铁离子、铜离子都产生沉淀,且引进新的杂质,故错误;
C.加入氨水,铁离子、铜离子都产生沉淀,且引进新的杂质,故错误;
D.加入CuO,CuO和稀硫酸反应生成硫酸铜和水,导致溶液pH升高,且不引进新的杂质,故正确;
固体c的化学式为Fe(OH)3,
故答案为:D;Fe(OH)3;
(4)1mol氨气通过加热的Cu2(OH)2CO3可以产生1.5mol金属铜,氨气被还原产生N2,则氨气和碱式碳酸铜的计量数之比为1mol:0.75mol=4:3,再结合原子守恒配平方程式为4NH3+3Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6Cu+3CO2+9H2O,故答案为:4NH3+3Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6Cu+3CO2+9H2O.
点评 本题考查物质分离和提纯,为高频考点,涉及试剂的选取、基本实验操作、除杂等知识点,明确实验原理是解本题关键,知道每个过程发生的反应及基本操作方法,注意选取试剂时不能引进新的杂质,注意(3)题是利用氢氧化铁溶解度受pH的影响选取试剂,而不是直接用铁离子和氢氧根离子反应生成氢氧化铁,为易错点.

 名校课堂系列答案
名校课堂系列答案| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
| A. | 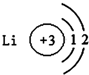 | B. | 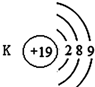 | C. | 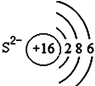 | D. |  |
| A. | 最高化合价按X、Y、Z的顺序减小 | B. | 阴离子的还原性按X、Y、Z顺序增强 | ||
| C. | 单质的氧化性按X、Y、Z顺序增强 | D. | 氢化物的稳定性按X、Y、Z顺序减小 |
| A. | C(Na+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| B. | C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) | |
| C. | C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-) | |
| D. | C(CO32-)+2C(OH-)=3C(H2CO3)+C(HCO3-)+2C(H+) |

(1)操作II、操作III的主要目的是除去杂质、富集铜元素.
(2)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.已知Cu(0H)2、Cu2(OH)2CO3、Cu4(0H)6S04均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃,设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol.L-1 HCl、1mol.L-1 H2SO4、O.1mol.L-1 NaOH、0.1mol.L-1 BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol.L-1HCl,充分振荡,再加0.1mol.L-1BaCl2溶液 | 说明悬浊液中混有白色沉淀产生,有Cu4(0H)6S04. |
| 步骤2:另取少量悬浊液于试管中将试管放入装有沸水的小烧杯中,用水浴加热一段时间,取出试管观察 | 试管中黑色沉淀生成,说明悬浊液中混有Cu(0H)2. |
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | N2 |
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯燃烧时产生浓烈的黑烟 | ||
| C. | 甲苯能使酸性高锰酸钾溶液褪色 | D. | 1mol甲苯可与3mol氢气加成 |
