题目内容
【题目】下列有关实验装置的说法中正确的是

A.用图1装置可用于气体的发生、干燥和收集,如铜屑与稀硝酸反应制备NO
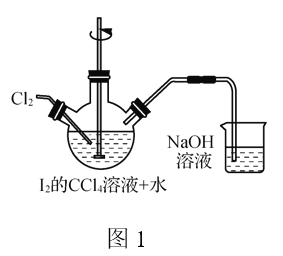
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可以验证FeCl3对H2O2分解反应有催化作用
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
【答案】B
【解析】
A. NO与空气中的O2会发生反应,不能使用排空气的方法收集NO,A错误;
B. 该装置为电解池,Fe为阳极,失去电子生成Fe2+,Fe2+与溶液中OH-结合形成Fe(OH)2,由于溶液表面覆盖煤油,可阻止空气中的氧气在溶液中的溶解,因此能较长时间观察Fe(OH)2沉淀的白色,B正确;
C. 该实验中反应温度不同,一个使用FeCl3、一个没有使用使用FeCl3,改变了两个外界条件,不能说明FeCl3对H2O2分解反应有催化作用,应该采用控制变量方法,其它外界条件都相同,只是一个使用FeCl3、一个没有使用FeCl3,这样才可以对比判断,C错误;
D. Cu与浓硝酸反应生成的NO2气体会与水反应产生NO,因此不能测定二氧化氮的体积,D错误;
故答案选B。

【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。