题目内容
【题目】用氢氧燃料电池电解苦卤水(苦卤水含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b均为石墨电极),下列有关说法正确的是
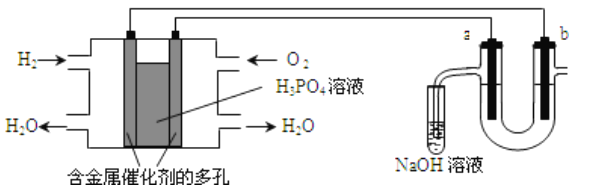
A. 燃料电池工作时,正极反应为:O2+4H++2e-===2H2O
B. 电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
C. 忽略能量损耗,当电池中消耗1.12LO2(标准状况)时,b极周围会产生0.1gH2
D. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
【答案】D
【解析】A、氢氧燃料电池中,正极上放电的是氧气,在酸性电解质环境下,电极反应式为:O2+4H++4e-===2H2O,选项A错误;B、电子在导线中移动,不能在溶液中移动,选项B错误;C、燃料电池和电解池中转移的电子数是相等的,当电池中消耗0.02gH2,根据电极反应:H2→2H++2e-,所以转移电子0.02mol,b极的电极反应为:2H++2e-→H2,转移电子0.02mol,会产生0.02gH2,选项C错误;D、还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Br-而不是Cl-,所以还原性:Br->Cl-,选项D正确;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡