题目内容
19.亚硝酸(HNO2)既可作氧化剂又可作还原剂.当亚硝酸在反应中作氧化剂时,可能生成的产物是( )| A. | N2 | B. | N2O3 | C. | NH3 | D. | NO2 |
分析 亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,N元素的化合价应降低,以此来解答.
解答 解:亚硝酸中N元素的化合价为+3价,当它在反应中作氧化剂时,N元素的化合价应降低,
A.N2中N元素的化合价为0价,可能为亚硝酸的还原产物,故A选;
B.N2O3中N元素的化合价为+3价,不会是亚硝酸的还原产物,故B不选;
C.NH3中N元素的化合价为-3价,可能为亚硝酸的还原产物,故C选;
D.NO2中N元素的化合价为+4价,不会是亚硝酸的还原产物,故D不选;
故选AC.
点评 本题考查氧化还原反应,明确氧化剂中元素的化合价降低时解答本题的关键,题目难度不大.

练习册系列答案
相关题目
9.下列有机物的命名正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 2,2,4-三甲基戊烷 | D. | 2一乙基一3一甲基已烷 |
10.在某无色强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Mg2+、SO42-、Cl- | B. | K+、Na+、CO32-、OH- | ||
| C. | Ca2+、MnO4-、NO3-、Cl- | D. | Na+、Cu2+、Ba2+、Cl- |
7.影响一定数量气体体积大小的主要因素是( )
| A. | 气体分子的摩尔质量 | B. | 微粒本身的大小 | ||
| C. | 微粒的质量 | D. | 微粒间的平均距离 |
14.下列叙述错误的是( )
| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 离子键的强弱主要决定于离子半径和离子所带电荷数 | |
| C. | 配位键在形成时,由成键双方各提供一个电子形成一对共用电子 | |
| D. | 金属键的实质是金属中的自由电子与金属阳离子形成的一种强烈的相互作用 |
4.下列说法中,不正确的是( )
| A. | 氢氧化铁胶体中分散质微粒直径为1~100nm | |
| B. | 可用丁达尔现象判断胶体的制备是否成功 | |
| C. | 溶液一定是均一、稳定的混合物 | |
| D. | 长期放置后不会分层的液体,就是溶液 |
11.常温下,向浓度为0.1mol•L-1硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的溶液,下列有关叙述中不正确的是( )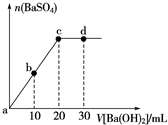

| A. | 溶液的pH:a<b<c<d | B. | 溶液的导电性:c<d | ||
| C. | a、b溶液呈酸性 | D. | c、d溶液呈碱性 |
8.下列反应的离子方程式书写正确的是( )
| A. | 往澄清石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 小苏打与醋酸反应:HCO3-+2H+═H2O+CO2↑ |
12.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)请将KMnO4氧化Fe2+的离子方程式补充完整:
□MnO4-+□Fe2++□8H+=□Mn2++□Fe3++□4H2O
(3)生成各种氢氧化物沉淀的pH如下表(金属离子的起始浓度为0.1mol•L-1)
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)请将KMnO4氧化Fe2+的离子方程式补充完整:
□MnO4-+□Fe2++□8H+=□Mn2++□Fe3++□4H2O
(3)生成各种氢氧化物沉淀的pH如下表(金属离子的起始浓度为0.1mol•L-1)
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.