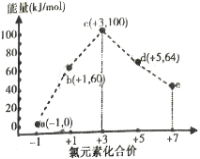
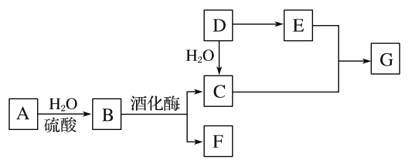
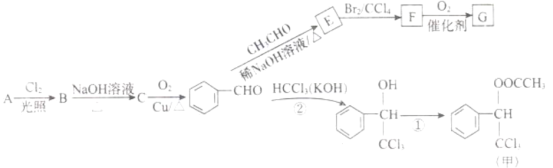
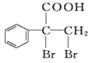
题目内容
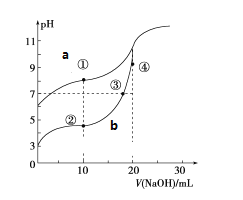
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-20,下列说法正确的是
A.该溶液的pH一定是10B.该溶液不可能pH=4
C.该溶液的pH不可能是7D.不会有这样的溶液
【答案】C
【解析】
根据酸或碱抑制水电离,含有弱根离子的盐水解,促进水电离,那么25℃时,纯水中水电离产生的c(H+)×c(OH-)=1×10-14,该溶液中由水电离产生的c(H+)×c(OH-)=1×10-20<1×10-14,说明该溶液中的溶质抑制了水电离,则溶液可能是酸或碱溶液。
A.如果溶液是酸溶液,则溶液中c(OH-)=1×10-10mol/L,c(H+)=![]() mol/L=1×10-4mol/L,则溶液的pH=4,如果溶液是碱溶液,则c(H+)=1×10-10mol/L,则溶液的pH=10,故A错误;
mol/L=1×10-4mol/L,则溶液的pH=4,如果溶液是碱溶液,则c(H+)=1×10-10mol/L,则溶液的pH=10,故A错误;
B.如果溶液是酸溶液,则溶液中c(OH-)=1×10-10mol/L,c(H+)=![]() mol/L=1×10-4mol/L,则溶液的pH=4,故B错误;
mol/L=1×10-4mol/L,则溶液的pH=4,故B错误;
C.通过以上分析知,该溶液为酸性或碱性溶液,溶液的pH不可能是7,故C正确;
D.通过以上分析知,有这样的溶液,故D错误;
答案为C

【题目】用0.1500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.60 |
回答下列问题:
(1)实验中,需要润洗的仪器是:________________________(填写仪器名称)。
(2)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是______________
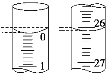
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则消耗盐酸溶液的体积为________mL。
(4)下列操作中会使所测结果偏高的是_________________、偏低的是_________________
①酸式滴定管漏液;②滴定前酸式滴定管尖嘴部分有气泡,滴定过程中气泡变小;③滴定过程中,振荡锥形瓶时,不小心将溶液溅出;④滴定过程中,锥形瓶内加少量蒸馏水; ⑤用甲基橙作指示剂进行滴定时,溶液由橙色变红色时停止滴定;⑥用甲基橙作指示剂,溶液由黄色变橙色,5 s后又变为黄色。⑦读酸式滴定管读数时,滴定前仰视读数
(5)未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。